一文汇总TCR-T细胞免疫疗法在肿瘤治疗的运用
原创一文汇总TCR-T细胞免疫疗法在肿瘤治疗的运用
原创
作者,Evil Genius
前面提到了,科服和临检的结合部分是VDJ和宏基因组,尤其是空间区域VDJ,拥有无限的运用前景,一旦建立靶向VDJ序列和特定肿瘤突变靶点之间的关系,那攻克肿瘤将会非常容易,前几天一位哈佛博后留学归来又跟我讨论起这个问题,他认为我提出的空间异质性区域的VDJ测序方案是目前最合理、也是最具可行性的方案,当然了,这个过程估计会比较漫长,但也不排除技术爆炸的可能,还有可能设及结构生物学、VDJ改造技术等内容(VDJ存在亲和力不足的为问题,通常需要基因改造)。
还有一个方向也是值得关注的,那就是中药领域的研究进展,中药其实对于抗肿瘤也有非常好的效果,而且非常有意思的一点,特检报告里面国外有的时候会推荐中药的辅助治疗,我真的有点害怕中药到时候研究出来的抗肿瘤药物专利权被国外拿走了,?,现在中药唯一欠缺的就是科学验证,无论是靶向药、化疗还有免疫疗法,都是严格的科学验证和临床试验,所以推荐药物的时候会陈列很多的证据,中药目前还是空白,需要有人可以努力做这个事,而且这方面很缺人,如果有人致力于这个方向,推荐天津的一家上市公司,天津天士力制药有限责任公司,感兴趣的话可以搜索一下。
还有一点就是,我发现大家对八卦很感兴趣,对于失业、裁员聊的不亦乐乎。
接下来我们看一看VDJ与肿瘤的研究进展。
1988年Dr. Michael Steinmetz 在Nature中报道了将TCR基因从一个T细胞转移到另一个T细胞,使第二个T细胞具有相同的抗原特异性。这是目前TCR基因治疗的起源。用于TCR抗体药物和细胞治疗的TCR需要经过工程化改造才有能获得理想的特异性肿瘤杀伤效果和安全性。
T细胞疗法是癌症免疫疗法的一个分支,旨在利用T细胞的特异性和功能来对抗肿瘤,主要包括:肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)、嵌合抗原受体T细胞(chimeric antigen receptor modified T cells,CAR-T)以及工程化T细胞受体修饰的T细胞(T-cell receptor-engineered T cells,TCR-T)等。
TCR-T的TCR结构和共刺激域
通过将能够特异性与抗原结合的TCR基因转入T淋巴细胞,使其获得与表达该抗原肿瘤细胞结合并诱发T细胞杀伤肿瘤细胞的能力。T细胞受体(TCRs)为T细胞提供识别信号,辅之以共刺激信号,该信号可以提供开/关信号来调节T细胞的激活。
T细胞受体是一种异二聚体,由两条不同的跨膜多肽链组成:一条α链和一条β链,每一条都包含一个固定区域,固定T细胞表面膜内的链,以及一个可变区域,识别并结合MHC呈递的抗原。额外的共刺激信号对T细胞功能的充分执行也是必不可少的,包括细胞毒性T细胞表面的CD8,它与I类MHC复合体结合,以及辅助性T细胞表面的CD4,它与II类MHC复合体结合
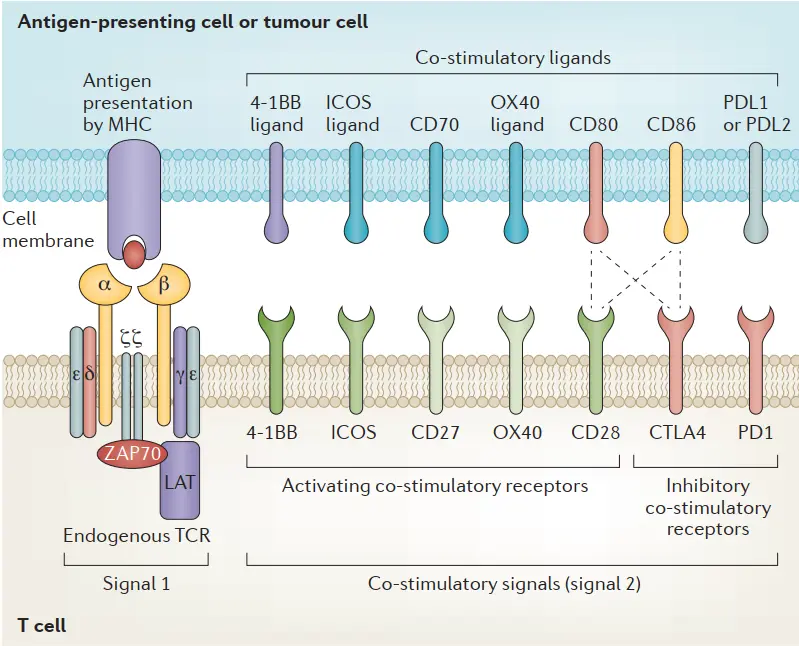
2013年,肿瘤免疫法被《科学》杂志评为年度十大科技突破之首,其中嵌合抗原受体( chimeric antigen receptor,CAR) -T 和 T细胞受体( T cell receptor,TCR) -T 细胞治疗是目前最受关注的疗法。由于TCR-T细胞识别具有高度简并性,可识别的抗原库更大;以及近年来测序技术、质谱技术和生物信息学技术的快速发展,体外鉴定肿瘤抗原肽及特异性TCR的手段日趋完善,因此TCR-T疗法极具实体瘤治疗优势。目前,TCR-T 疗法凭借①细胞内外肿瘤特异性抗原都可识别、②靶向实体瘤效果更明显、③体内存留时间更长等特点,已经成为继CAR-T细胞治疗后新一代抗肿瘤利器。
TCR-T与CAR-T作用机制的差异
T细胞疗法是癌症免疫疗法的一个分支,旨在利用T细胞的特异性和功能来对抗肿瘤,主要包括:肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)、嵌合抗原受体T细胞(chimeric antigen receptor modified T cells,CAR-T)以及工程化T细胞受体修饰的T细胞(T-cell receptor-engineered T cells,TCR-T)等。
TCR-T的TCR结构和共刺激域
通过将能够特异性与抗原结合的TCR基因转入T淋巴细胞,使其获得与表达该抗原肿瘤细胞结合并诱发T细胞杀伤肿瘤细胞的能力。T细胞受体(TCRs)为T细胞提供识别信号,辅之以共刺激信号,该信号可以提供开/关信号来调节T细胞的激活。
T细胞受体是一种异二聚体,由两条不同的跨膜多肽链组成:一条α链和一条β链,每一条都包含一个固定区域,固定T细胞表面膜内的链,以及一个可变区域,识别并结合MHC呈递的抗原。额外的共刺激信号对T细胞功能的充分执行也是必不可少的,包括细胞毒性T细胞表面的CD8,它与I类MHC复合体结合,以及辅助性T细胞表面的CD4,它与II类MHC复合体结合[1]。
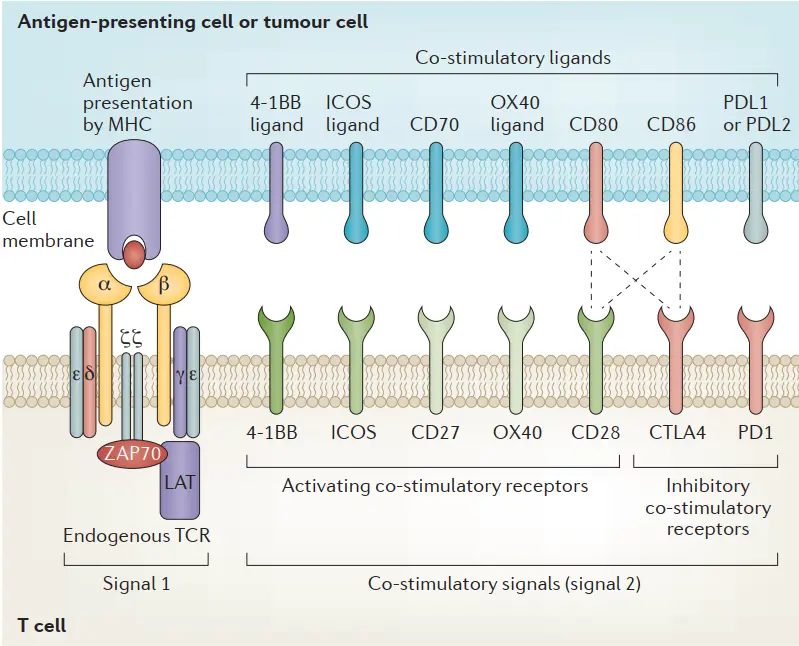
TCR-T与CAR-T作用机制的差异
目前,CAR-T在血液系统恶性肿瘤的临床治疗中效果显著。由于实体肿瘤的免疫抑制肿瘤微环境和肿瘤细胞表面的肿瘤相关抗原表达率较低(1 - 10%)等因素,限制了CAR-T在实体肿瘤的临床应用。
不同于CAR-T细胞只能识别细胞膜外的蛋白质,TCR-T细胞的主要优势是能够识别细胞外和细胞内的蛋白,而超过85%的细胞蛋白位于细胞内,所以对于实体瘤,TCR-T可以发挥更好的作用。
TCR的效力依赖于它与肽-主要组织相容性复合体(pMHC)的相互作用,pMHC即为肽结合于MHC形成的复合物。来自T细胞的TCR必须与患者的人类白细胞抗原(HLA)等位基因匹配,识别这些pMHC并杀伤癌细胞
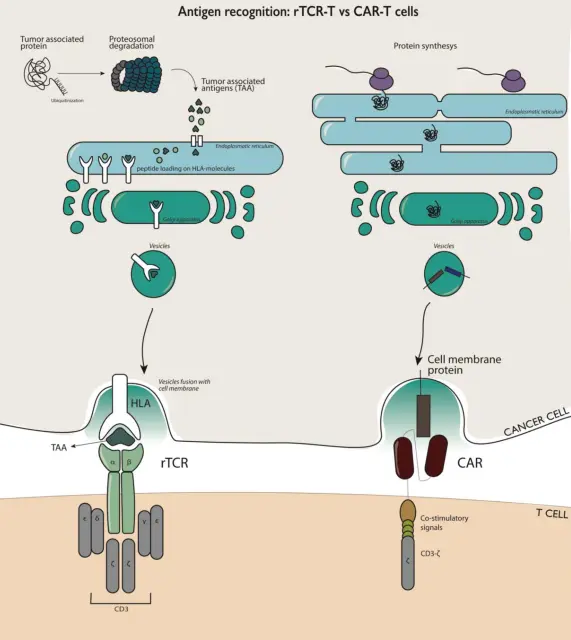
TCR-T 细胞疗法是筛选和鉴定能够特异性结合选择靶点抗原的TCR 序列,通过基因工程手段将其转入到患者外周血来源的 T 细胞中( 或异源T细胞) ,再将改造后的 T 细胞回输至患者体内,使其特异性识别和杀伤表达抗原的肿瘤细胞,从而达到治疗肿瘤的目的。
TCRs与pMHC的亲和力问题
体内天然的TCRs虽然表现出与抗体相似的遗传和序列多样性,但TCRs的结合亲和力比抗体要低几个数量级。抗体通常以nM或pM范围内的KD值结合它们的同源抗原。而TCRs以低(微摩尔)的亲和力与peptide-MHC复合物(p-MHC)结合。这是由于T细胞在胸腺发育和成熟过程中没有体细胞突变和亲和力成熟的过程,并且TCR与同源抗原结合过强的T细胞被阴性选择消除,而结合过弱的T细胞则经细胞凋亡消除。这种编辑机制显著降低自身免疫性疾病的风险,但也限制了天然免疫系统识别TAA的能力,因为在大多数情况下,这些肽来源于在肿瘤中重新表达或过表达的自身蛋白。一般而言,TCR对作为“自身”抗原的癌症相关抗原的结合亲和力比TCR对非自身和微生物抗原的结合亲和力低约10倍左右。
T细胞的活化取决于TCR–pMHC的结合动力学,而TCR–pMHC的结合动力学又受肿瘤细胞或APC细胞膜上抗原密度的影响。尽管TCR亲和力与T细胞活性之间的相关性存在一些分歧,但选择高亲和力TCR或通过定向进化微调TCR的亲和力都是改善TCR-T抗肿瘤反应的技术手段。
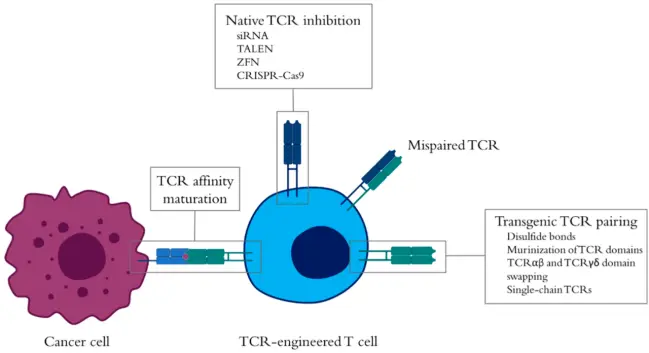
从数据中选择稳定的scTCRs克隆
单细胞空间技术已经可以实现特定VDJ的测序分析,从而提供了一个特定方向的VDJ数据库,之后,在文库筛选阶段,使用的p-MHC进行分选,分离出具有低纳摩尔亲和力的scTCRs。
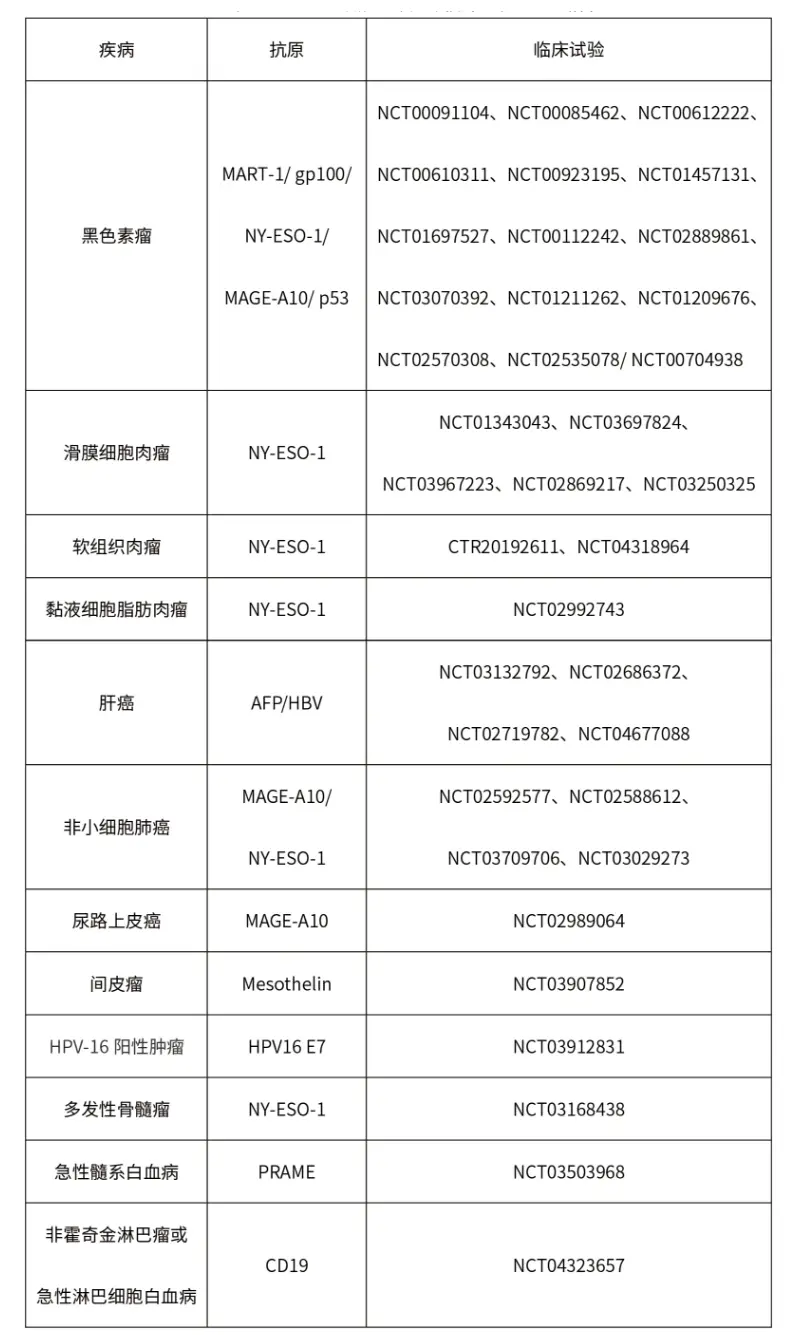
TCR-T的抗原
NY-ESO是最主要的肿瘤相关性抗原。目前这方面的研究美国处于尖端位置。
根据Cortellis数据库,截至目前全球在研的TCR-T项目中,70%以上适应症为实体瘤,主要包括转移性非小细胞肺癌、肝细胞癌、多发性骨髓瘤、软组织肉瘤、头颈癌、黑色素瘤、脂肪肉瘤和宫颈癌等。从靶点来看,癌-睾丸(CT)抗原依然是研发热点,靶向NY-ESO-1的项目数量位居前列。NY-ESO-1是最常见的靶向抗原,在多种癌症中均有表达,包括骨髓瘤、黑色素瘤等。其他肿瘤睾丸相关抗原,如PRAME和MAGE蛋白,以及黑色素瘤分化抗原MART-1和gp100,以及最近的癌症驱动因子,如WT1、KRAS和TP53,也是流行的TCR-T靶点。
2023年5月11日,据国家食品药品监督管理局药品审评中心官网公示,恒瑞源正 (上海)生物科技有限公司的HRYZ-T101注射液获得临床试验默示许可,用于治疗人乳头瘤病毒18亚型阳性 (HPV18+)的实体瘤。
总之,TCR-T疗法是未来研究的重点领域,目前还需要大量的投入和人才。
生活很好,有你更好
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。