GEO数据挖掘
原创1 图表介绍
1.1 热图
输入数据:数值型矩阵/数据框
颜色深浅代表数值的大小
1.2 散点图
1.3 箱线图
1.3.1 输入数据
横坐标:一个有重复值的离散型变量
纵坐标:连续型向量
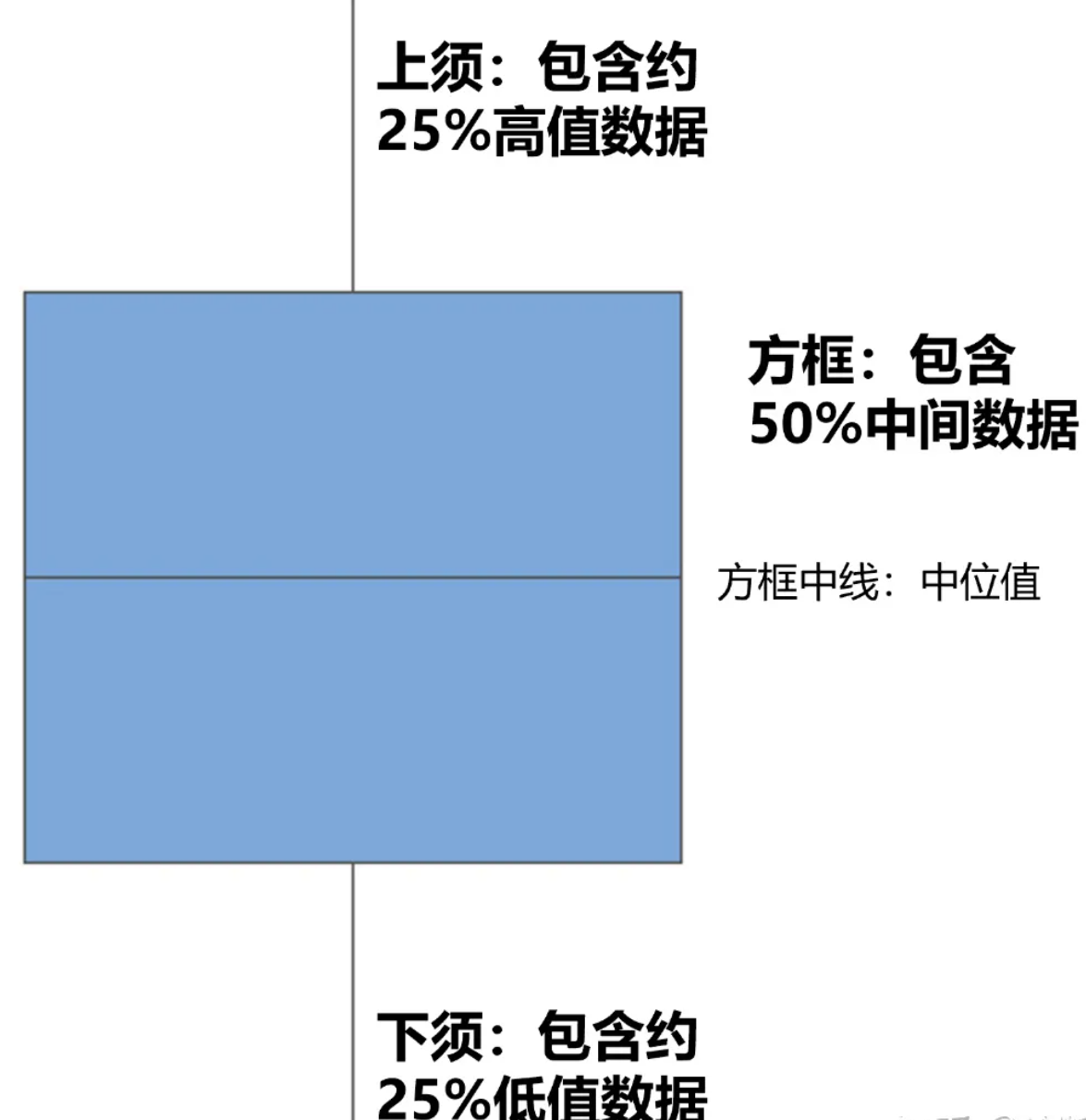
1.3.2 箱线图中五条线的含义
箱线图比较分布情况
箱型图不显示原始数据点,而是采用样本数据,根据四分位数用盒和线来显示值的范围。此外,它们用星号显示落在箱须之外的离群值
箱形图显示五个数据:
1、最小的数字(最小值)
2、第一个四分位数(25%位点值)
3、中间的数字(中位值)
4、第三个四分位数(75%位点值)
5、最大的数字(最大值)
箱线图用于比较单个基因在两组之间(control/treat)之间的表达量差异
在多基因中用于选出分布差异较大的基因
1.4 火山图
1.4.1 火山图的横纵坐标及其含义
1.4.1.1 横坐标:logFC
Foldchange(FC):处理组平均值/对照组平均值
logFoldchange(logFC):Foldchange取log2
表达矩阵中的count一般为取过log之后的数值
处理组在前,对照组在后!反了全错!
1.4.1.2 纵坐标:p值
1.4.2 火山图怎么看?
logFC>0,treat>control,基因表达量上升;
logFC<0,treat<control,基因表达量下降。
基因表达上升/下降≠差异基因!还要看阈值的设定(logFC+p值)
通常所说的上调/下调基因:表达量显著上升/下降的基因
上调基因:logFC>1,p<0.01
下调基因:logFC<-1,p<0.01
可以通过“阈值调整”改变差异基因的数量
logFC的常见阈值:1、2、1.2、1.5、2.2
火山图是用limma差异分析结果来做的,limma差异分析结果是一个10列的数据框
1.5 PCA主成分分析图
1.5.1 PCA的原理
主成分分析:旨在利用降维的思想,把多指标转化为少数几个综合指标(即主成分)
根据这些主成分对样本进行聚类,代表样本的点(中心点除外)在坐标轴上的距离越远,说明样本差异越大
1.5.2 PCA的用途
用于“预实验”,简单查看组间是否有差别
- 同一分组是否聚成一簇(组内重复好)
- 中心点之间是否有距离(组间差别大)
从这里开始没有课件,以下内容为自己结合课堂视频整理得出~
2 GEO背景知识+表达芯片分析思路
2.1 表达数据实验设计
实验目的:通过基因表达量数据的差异分析和富集分析来解释生物学现象
有差异的材料→差异基因→找功能/找关联→解释差异,缩小基因范
?数据挖掘本质:逐步缩小感兴趣的基因范围!
2.2 GEO数据库介绍
GSM:用户提交给GEO的样本数据(Sample)
GSE:一个完整的研究,提供了整个研究的描述(Series)
GPL:用户测定表达量使用的芯片/平台(Platform)
2.3 基因表达芯片的原理
探针的表达量代表基因的表达量
2.4 分析思路
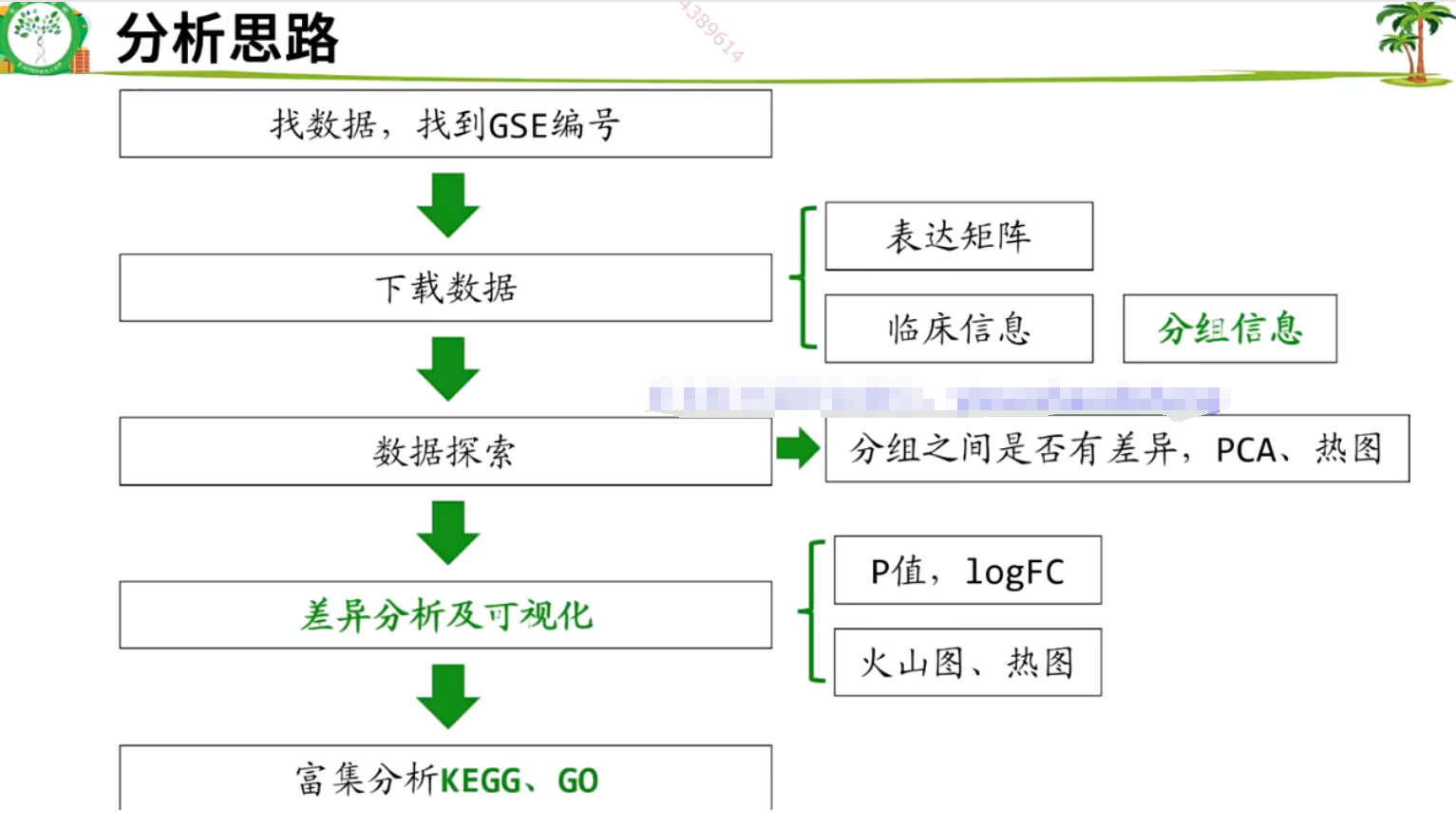
2.5 表达矩阵
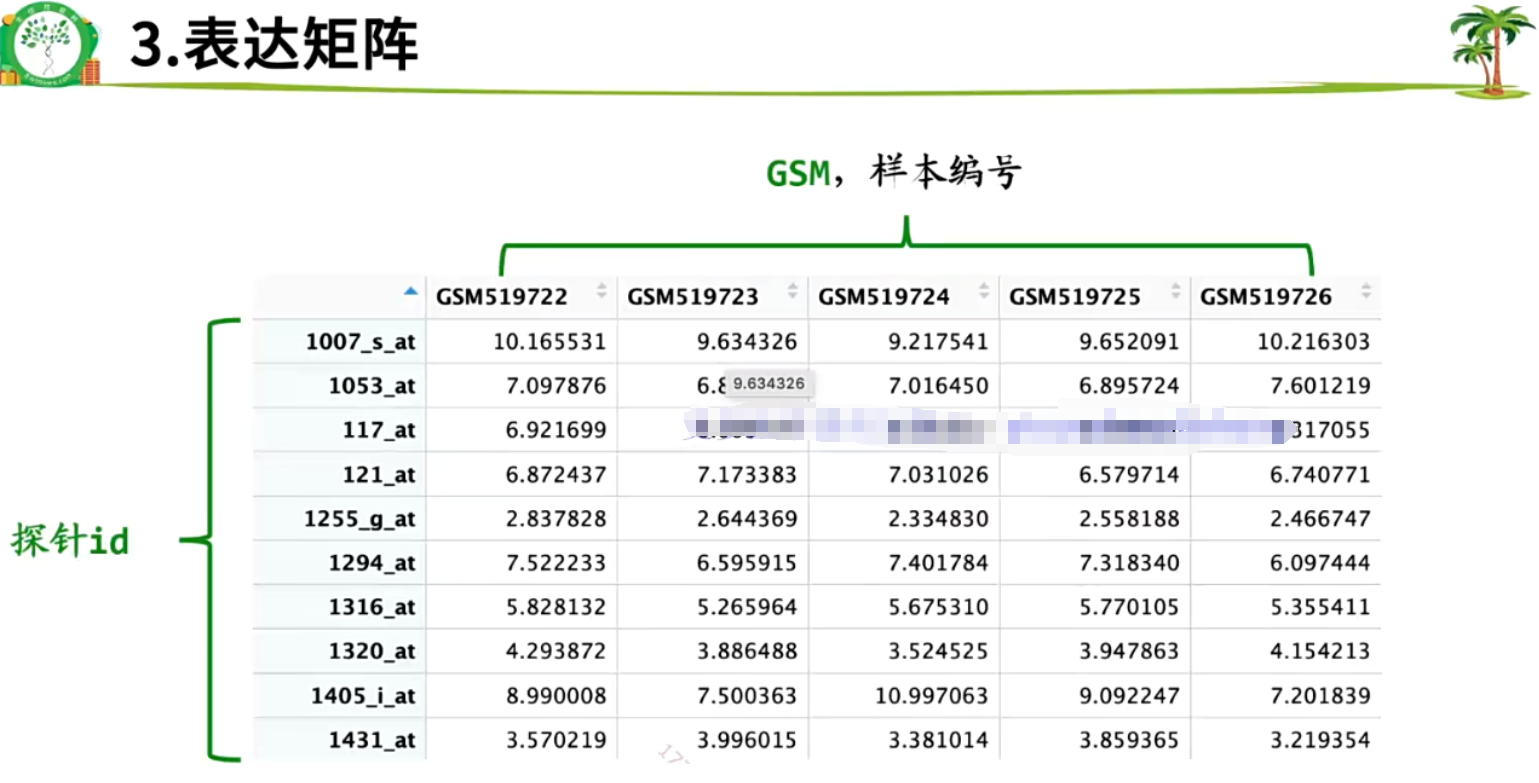
- 探针id要找到对应的基因sample
- 样本编号GSM要获取分组信息group
2.6 富集分析
2.6.1 什么是基因的Entrezid?
输入数据:差异基因的Entrezid
Symbol为常说的基因名
并非一一对应,会损失/增加一部分基因
2.6.2 富集分析的数据库
2.6.2.1 KEGG数据库
通路pathway
2.6.2.2 GO数据库
细胞组分(cellular component)
分子功能(molecular function)
生物过程(biological process)
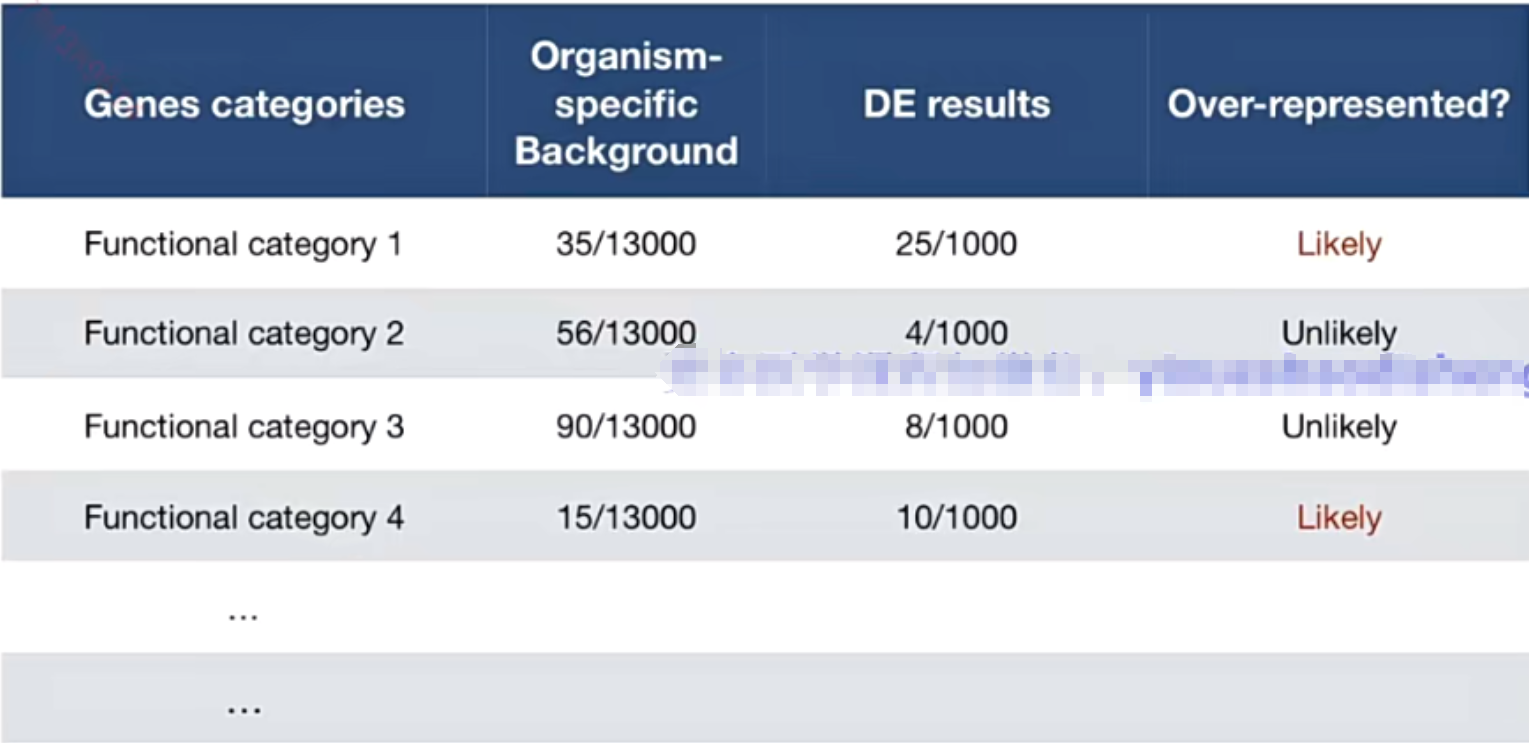
2.6.3 富集分析结果
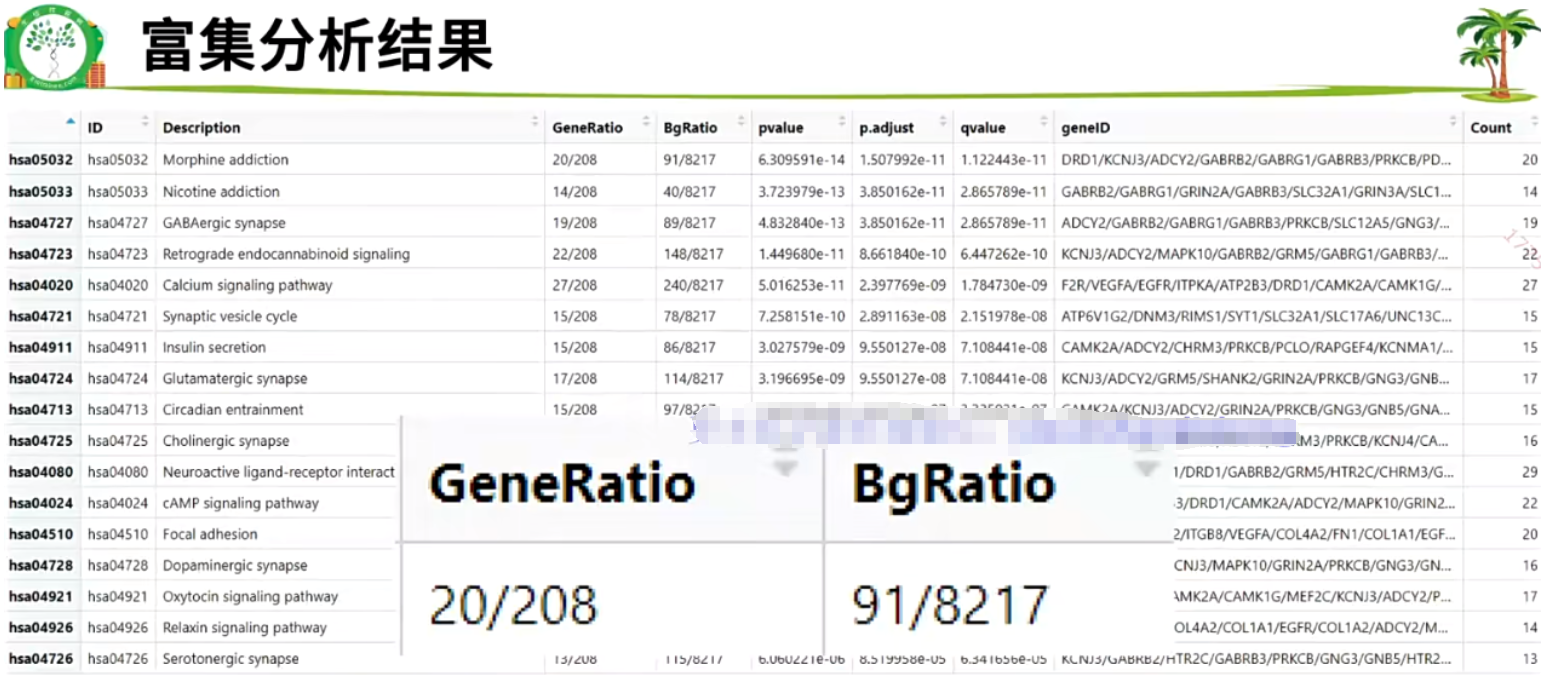
GeneRatio:差异基因中有哪些属于这条通路/差异基因中有多少个被数据库收录
BgRatio:这条通路一共有多少个基因/数据库中所有通路总共多少个基因
?富集分析本质:衡量某个通路里的基因在差异基因里是否足够多
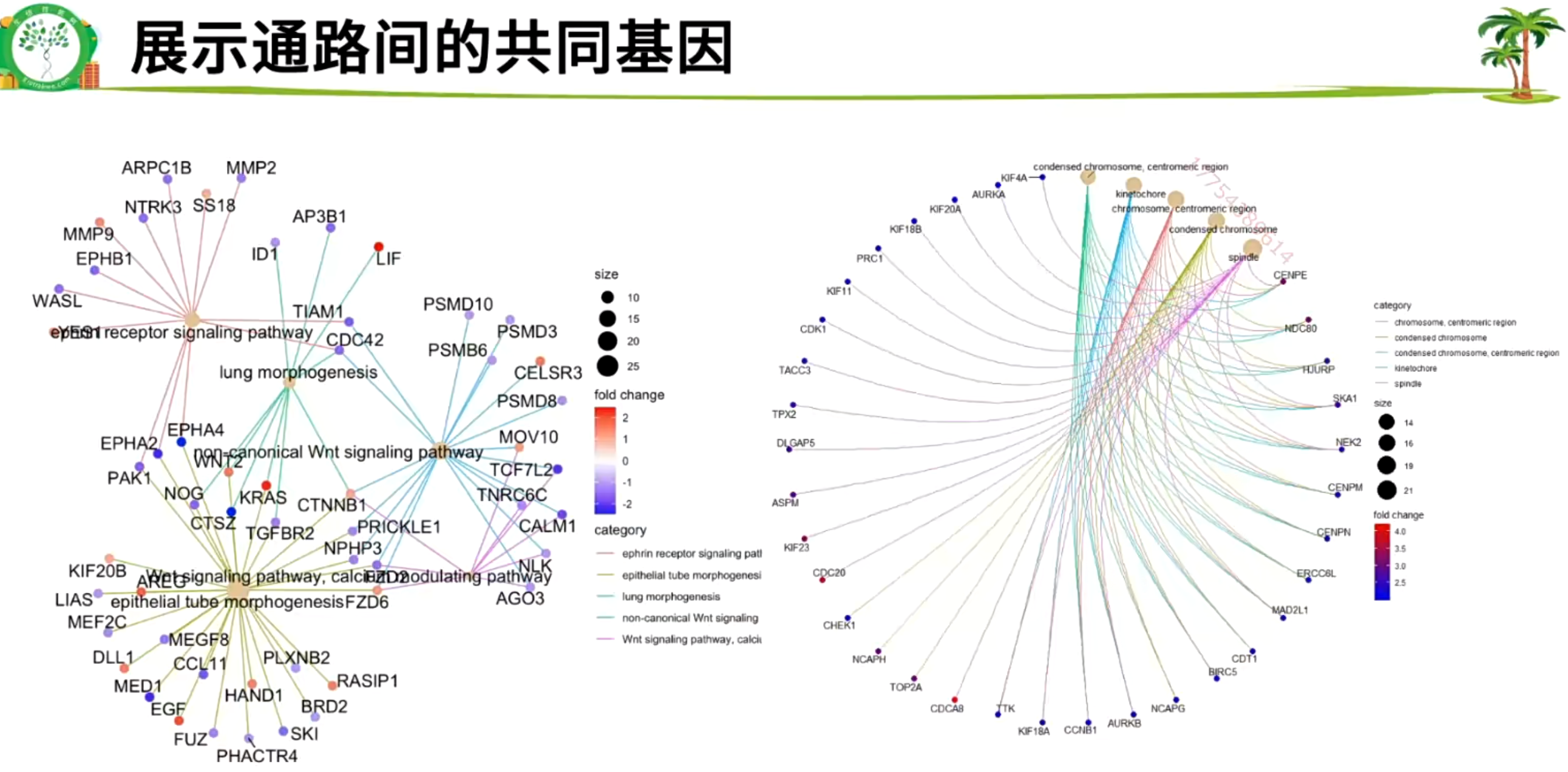
2.6.4 富集分析的可视化
气泡图、柱状图/条形图
Y叔Clusterprofiler 默认使用p.adjust
可以按照CC、MF、BP对图片进行分面
也可以上、下调基因分开富集,合并画图
3 代码分析流程
3.1 安装需要的R包
options("repos"="https://mirrors.ustc.edu.cn/CRAN/")
if(!require("BiocManager")) install.packages("BiocManager",update = F,ask = F)
options(BioC_mirror="https://mirrors.ustc.edu.cn/bioc/")
cran_packages <- c('tidyr',
'tibble',
'dplyr',
'stringr',
'ggplot2',
'ggpubr',
'factoextra',
'FactoMineR',
'devtools',
'cowplot',
'patchwork',
'basetheme',
'paletteer',
'AnnoProbe',
'ggthemes',
'VennDiagram',
'tinyarray')
Biocductor_packages <- c('GEOquery',
'hgu133plus2.db',
'ggnewscale',
"limma",
"impute",
"GSEABase",
"GSVA",
"clusterProfiler",
"org.Hs.eg.db",
"preprocessCore",
"enrichplot")
for (pkg in cran_packages){
if (! require(pkg,character.only=T) ) {
install.packages(pkg,ask = F,update = F)
require(pkg,character.only=T)
}
}
for (pkg in Biocductor_packages){
if (! require(pkg,character.only=T) ) {
BiocManager::install(pkg,ask = F,update = F)
require(pkg,character.only=T)
}
}
#前面的所有提示和报错都先不要管。主要看这里
for (pkg in c(Biocductor_packages,cran_packages)){
require(pkg,character.only=T)
}3.2 GEO数据下载并从中提取有用信息
rm(list = ls())
library(GEOquery)
#先去网页确定是否是表达芯片数据,不是的话不能用本流程。
gse_number = "GSE56649"
eSet <- getGEO(gse_number, destdir = '.', getGPL = F) #实现下载并读取eSet = eSet[[1]] #eSet脱离列表的壳子R语言中狭义的对象:R包的作者以某种特定的方式组织起来的数据
ExpressionSet对象 出自Biobase包
#(1)提取表达矩阵exp
exp <- exprs(eSet)
dim(exp)
exp[1:4,1:4]
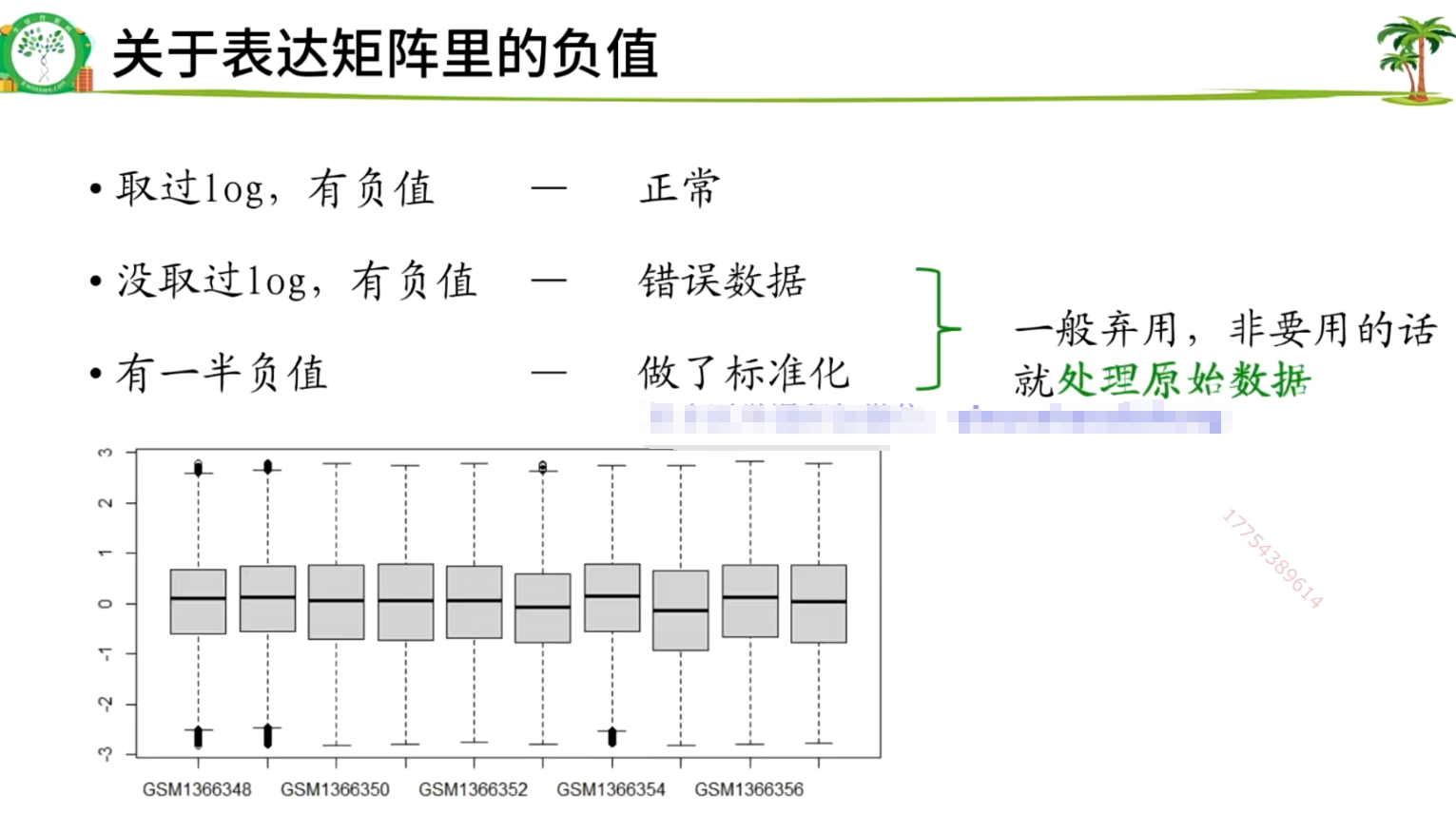
#检查矩阵是否正常,如果是空的就会报错,空的和有负值的、有异常值的矩阵需要处理原始数据。
#如果表达矩阵为空,大多数是转录组数据,不能用这个流程(后面另讲)。
#自行判断是否需要log
exp = log2(exp+1)
boxplot(exp)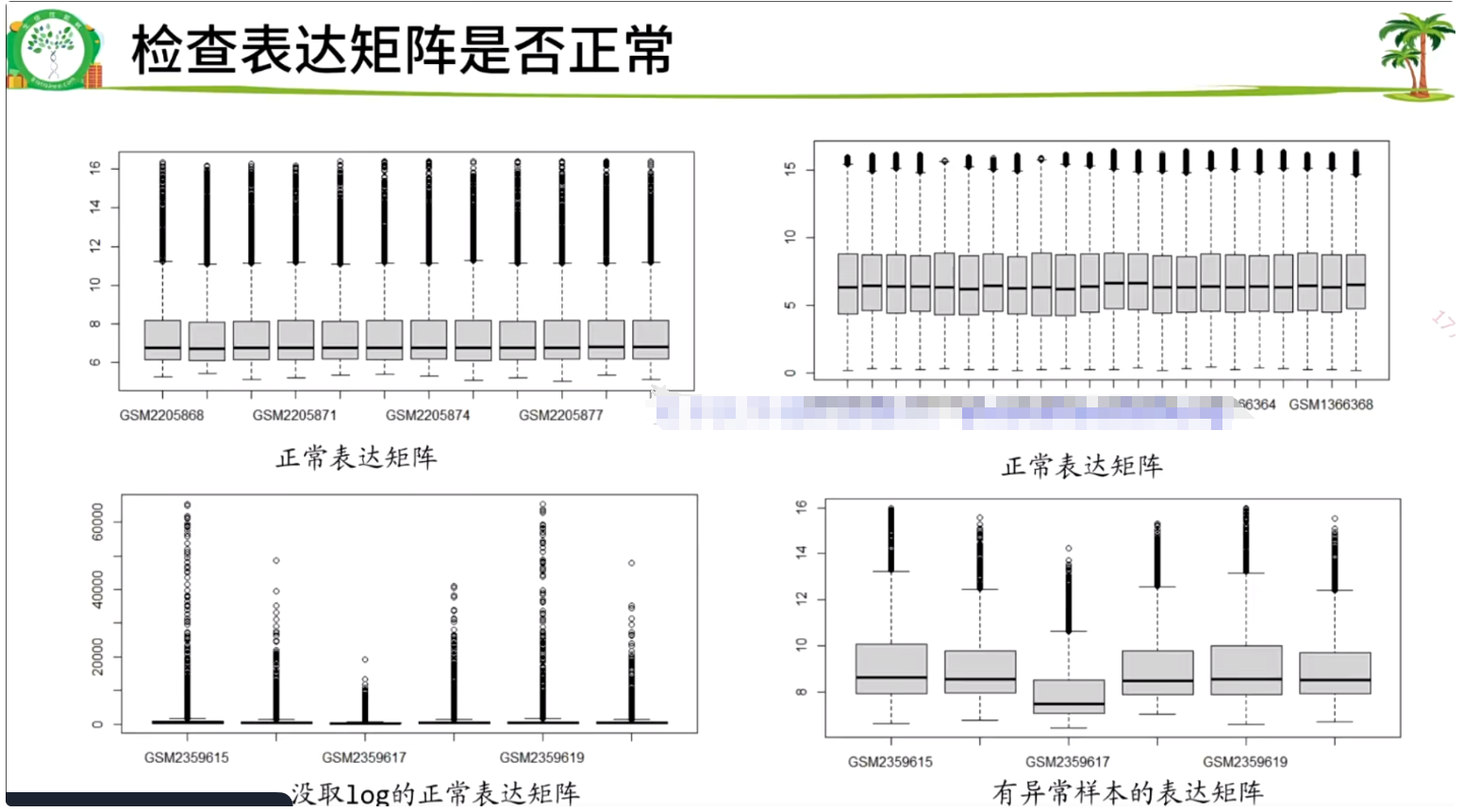
取过log的数据正常范围在0-20之间
画箱线图看有没有异常数据
#(2)提取临床信息
pd <- pData(eSet)#(3)让exp列名与pd的行名顺序完全一致 临床信息中的分组信息与表达矩对应
p = identical(rownames(pd),colnames(exp));p
if(!p) exp = exp[,match(rownames(pd),colnames(exp))]#(4)提取芯片平台编号
gpl_number <- eSet@annotation;gpl_number #@给对象提取子集
save(gse_number,pd,exp,gpl_number,file = "step1output.Rdata")3.3 ?获取分组信息和探针注释
长脚本管理方式:
2个脚本之间的衔接:清空环境变量+load Rdata
3.3.1 获取分组信息的三种方法:
- 有现成的可以用来分组的列
- 自己生成
- 使用字符串处理的函数获取分组
# Group(实验分组)和ids(探针注释)
rm(list = ls())
load(file = "step1output.Rdata")
library(stringr)
# 标准流程代码是二分组,多分组数据的分析后面另讲
# 生成Group向量的三种常规方法,三选一,选谁就把第几个逻辑值写成T,另外两个为F。如果三种办法都不适用,可以继续往后写else if
if(F){
# 1.Group----
# 第一种方法,有现成的可以用来分组的列
Group = pd$`disease state:ch1`
}else if(F){
# 第二种方法,自己生成
Group = c(rep("RA",times=13),
rep("control",times=9))
Group = rep(c("RA","control"),times = c(13,9))
}else if(T){
# 第三种方法,使用字符串处理的函数获取分组
Group=ifelse(str_detect(pd$source_name_ch1,"control"),
"control",
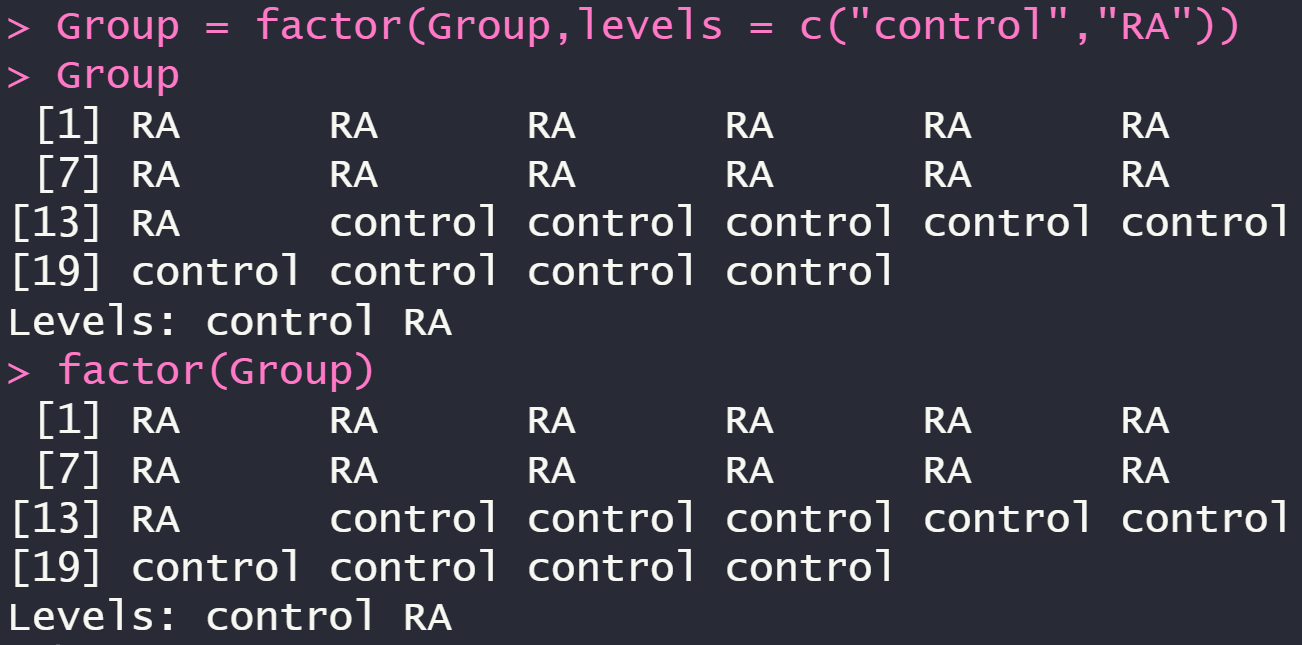
"RA")}因子:带有levels属性的特殊的向量
# 需要把Group转换成因子,并设置参考水平,指定levels,对照组在前,处理组在后
Group = factor(Group,levels = c("control","RA"))
Group在第一个位置上的为参考水平,做差异分析时作为对照组
3.3.2 探针注释的获取
3.3.2.1 探针注释的定义及来源
探针注释:探针与基因的对应关系 不是所有的GPL都能找到注释!
注释来源:
- Bioconductor的注释包
- GPL的表格文件解析
- 官网下载对应产品的注释表格
- 自主注释3.3.2.2 探针注释的代码
library(tinyarray)
find_anno(gpl_number) #打出找注释的代码
ids <- AnnoProbe::idmap('GPL570') #此时已经找到了探针注释,后面的代码不需要再运行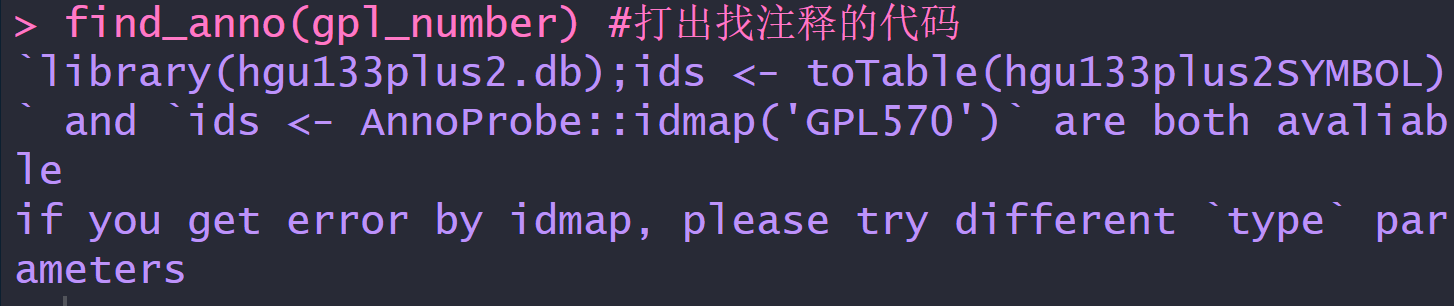
找探针注释的四种方法:(原始、基础)
- Bioconductor中的R包(最常用) 在> http://www.bio-info-trainee.com/1399.html 网站上找
gpl_number
#http://www.bio-info-trainee.com/1399.html
if(!require(hgu133plus2.db))BiocManager::install("hgu133plus2.db") #加后缀.db
library(hgu133plus2.db)
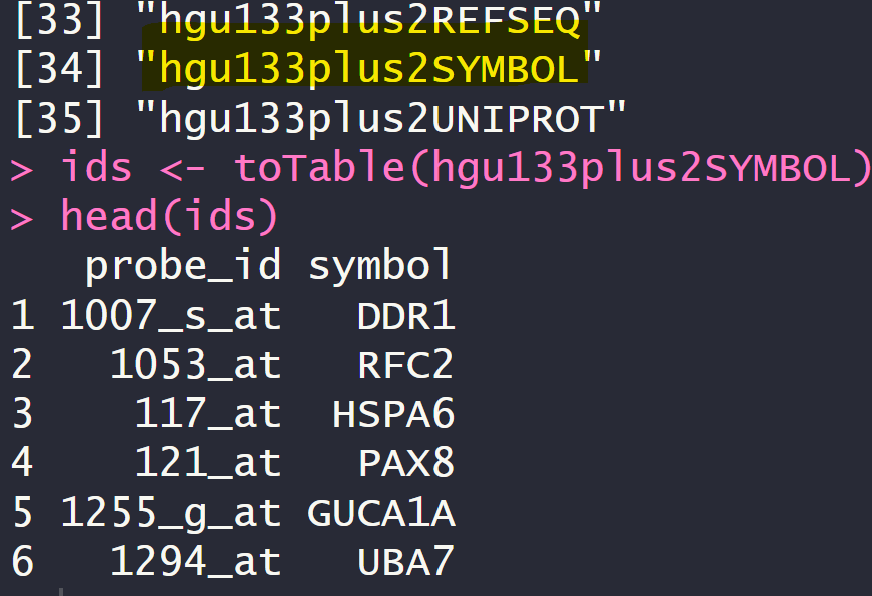
ls("package:hgu133plus2.db") #列出一个R包里有什么函数/数据
ids <- toTable(hgu133plus2SYMBOL)
head(ids)
- 读取GPL网页的表格文件,按列取子集
##https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GPL570
if(F){
#注:表格读取参数、文件列名不统一,活学活用,有的表格里没有symbol列,也有的GPL平台没有提供注释表格
b = read.delim("GPL570-55999.txt", #read.table()的小分支
check.names = F, #不要把列名里的特殊字符转化为.
comment.char = "#") #开头的行作为注释行
colnames(b)
ids2 = b[,c("ID","Gene Symbol")]
colnames(ids2) = c("probe_id","symbol") #为了后续的两个表格连接改列名
k1 = ids2$symbol!="";table(k1) #去除没有基因对应的探针
k2 = !str_detect(ids2$symbol,"///");table(k2) #去除非特异性探针(一个探针对应多个基因)
ids2 = ids2[ k1 & k2,]
# ids = ids2
}save(exp,Group,ids,gse_number,file = "step2output.Rdata")补充:AnnoProbe包
AnnoProbe包里的三个函数:
idmap:下载注释信息(探针与基因symbol的对应关系) 获得ids
geoChina:下载GSE数据
annoGene:给基因提供注释
library(AnnoProbe)
?idmap
ids=idmap('GPL570')
?geoChina
geoChina(gse = "GSE2546", mirror = "tercent")
?annoGenetinyarray包:geo_download函数
get_deg_all直接进行差异分析及可视化 需要找到group和ids
3.4 画PCA图+Top1000基因热图
3.4.1 PCA图
输入数据:表达矩阵+分组信息
dat=as.data.frame(t(exp)) #转置 转置以后都变成了矩阵 再从矩阵变为数据框
library(FactoMineR)
library(factoextra)
dat.pca <- PCA(dat, graph = FALSE)
pca_plot <- fviz_pca_ind(dat.pca,
geom.ind = "point", # show points only (nbut not "text")
col.ind = Group, # color by groups
palette = c("#00AFBB", "#E7B800"),
addEllipses = TRUE, # Concentration ellipses
legend.title = "Groups"
)
pca_plot
save(pca_plot,file = "pca_plot.Rdata") #方便后续与其他图进行拼图画图思路:
3.4.2 热图
cg=names(tail(sort(apply(exp,1,sd)),1000)) #隐式循环取方差最大的1000个基因
n=exp[cg,]
# 直接画热图,对比不鲜明 直接拿表达量数据画图
library(pheatmap)
annotation_col=data.frame(group=Group)
rownames(annotation_col)=colnames(n)
pheatmap(n,
show_colnames =F,
show_rownames = F,
annotation_col=annotation_col
)
# 按行标准化 让热图对比更加鲜明 突出显示行内部的变化
pheatmap(n,
show_colnames =F,
show_rownames = F,
annotation_col=annotation_col, #在上方添加注释条
scale = "row",
breaks = seq(-3,3,length.out = 100) #设置颜色分配范围→避免离群值对整张图产生的影响
)
dev.off()3.5 差异分析
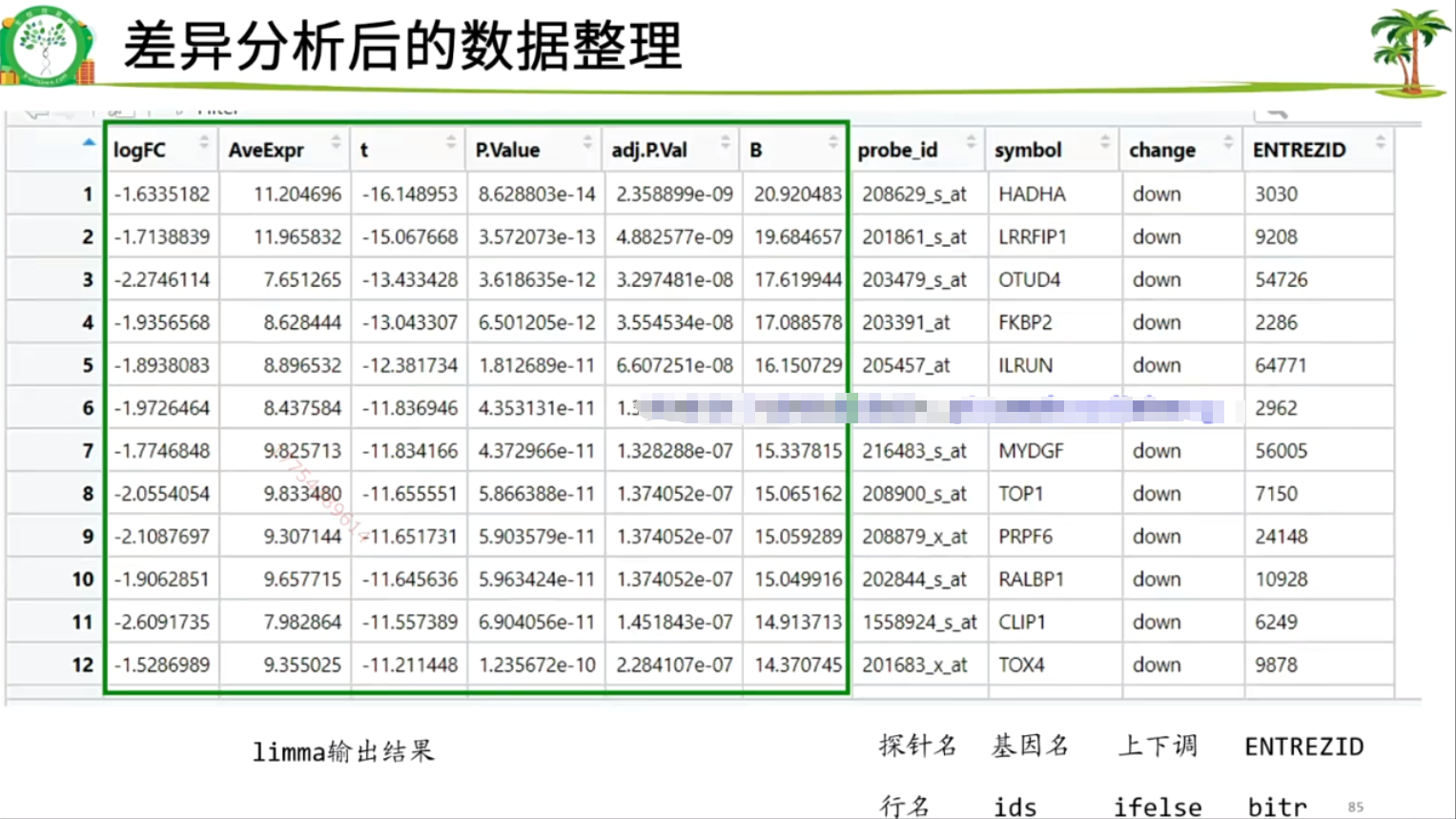
差异分析得到的结果:
rm(list = ls())
load(file = "step2output.Rdata")
#差异分析,用limma包来做
#需要表达矩阵和Group,不需要改
library(limma) #输入数据Group和exp,输出数据deg 把以下几行代码看作一个整体
design=model.matrix(~Group)
fit=lmFit(exp,design)
fit=eBayes(fit)
deg=topTable(fit,coef=2,number = Inf)
#为deg数据框添加几列
#1.加probe_id列,把行名变成一列
library(dplyr)
deg <- mutate(deg,probe_id=rownames(deg))
#2.加上探针注释
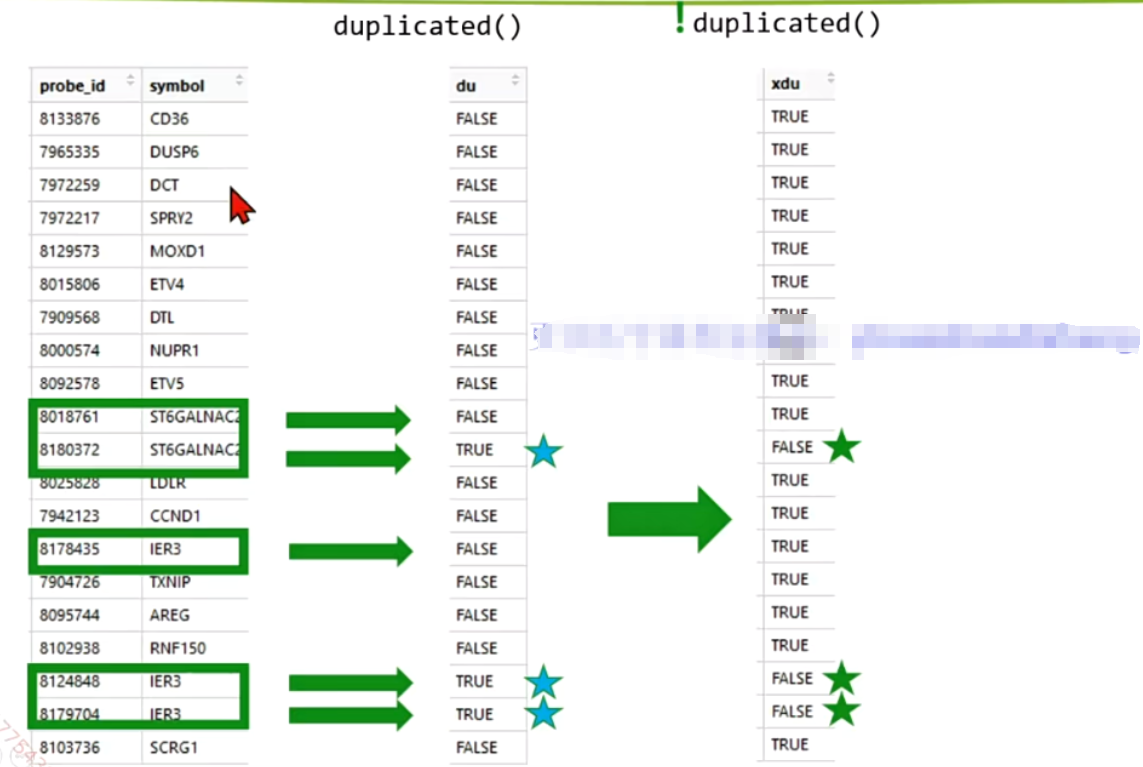
ids = ids[!duplicated(ids$symbol),]
#其他去重方式在zz.去重方式.R
deg <- inner_join(deg,ids,by="probe_id")
nrow(deg)
#3.加change列,标记上下调基因
logFC_t=1
P.Value_t = 0.05
k1 = (deg$P.Value < P.Value_t)&(deg$logFC < -logFC_t)
k2 = (deg$P.Value < P.Value_t)&(deg$logFC > logFC_t)
deg <- mutate(deg,change = ifelse(k1,"down",ifelse(k2,"up","stable")))
table(deg$change)
#4.加ENTREZID列,用于富集分析(symbol转entrezid,然后inner_join)
library(clusterProfiler)
library(org.Hs.eg.db) #转换依据 Hs为人类
s2e <- bitr(deg$symbol,
fromType = "SYMBOL", #从……基因类型转换为……基因类型
toType = "ENTREZID",
OrgDb = org.Hs.eg.db)#人类
#其他物种http://bioconductor.org/packages/release/BiocViews.html#___OrgDb
deg <- inner_join(deg,s2e,by=c("symbol"="SYMBOL"))
save(Group,deg,logFC_t,P.Value_t,gse_number,file = "step4output.Rdata")探针注释:多个探针对应一个基因
- 随机去重
- 保留行和/行平均值最大的探针
- 取多个探针的平均值
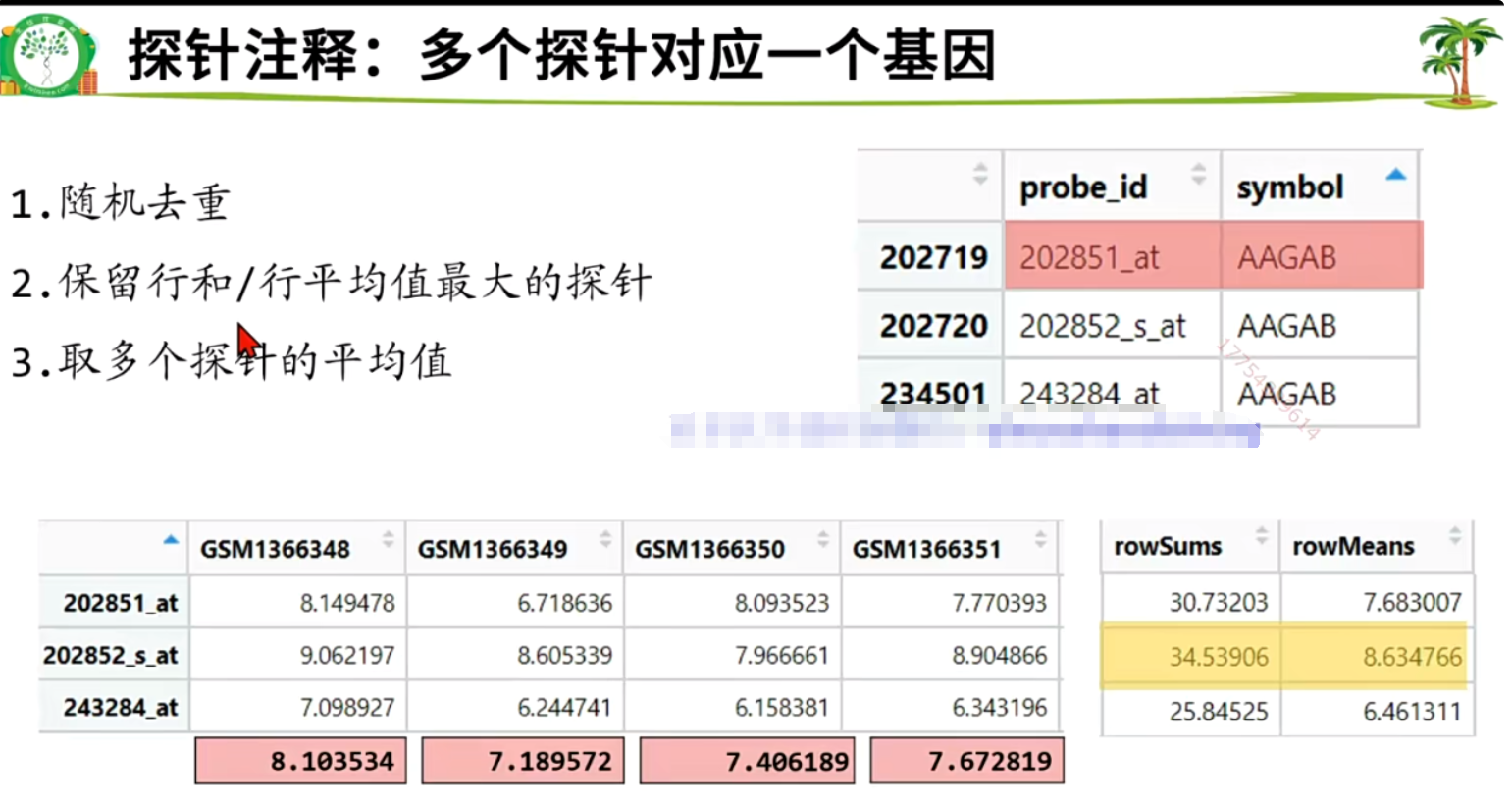
如何实现随机去重?
3.6 画图
rm(list = ls())
load(file = "step1output.Rdata")
load(file = "step4output.Rdata")
#1.火山图----
library(dplyr)
library(ggplot2)
dat = deg[!duplicated(deg$symbol),]
p <- ggplot(data = dat,
aes(x = logFC,
y = -log10(P.Value))) +
geom_point(alpha=0.4, size=3.5,
aes(color=change)) +
scale_color_manual(values=c("blue", "grey","red"))+ #改颜色
geom_vline(xintercept=c(-logFC_t,logFC_t),lty=4,col="black",linewidth=0.8) +
geom_hline(yintercept = -log10(P.Value_t),lty=4,col="black",linewidth=0.8) +
theme_bw()
p
#在火山图上添加感兴趣的基因 叠加一个新的图层
#ggplot叠加的不同图层可以使用不同的数据
for_label <- dat%>%
filter(symbol %in% c("HADHA","LRRFIP1"))
volcano_plot <- p +
geom_point(size = 3, shape = 1, data = for_label) +
ggrepel::geom_label_repel(
aes(label = symbol),
data = for_label,
color="black"
)
volcano_plot
#2.差异基因热图----
load(file = 'step2output.Rdata')
# 表达矩阵行名替换
exp = exp[dat$probe_id,]
rownames(exp) = dat$symbol
if(F){
#全部差异基因
cg = dat$symbol[dat$change !="stable"]
length(cg)
}else{
#取前10上调和前10下调
library(dplyr)
dat2 = dat %>%
filter(change!="stable") %>%
arrange(logFC)
cg = c(head(dat2$symbol,10),
tail(dat2$symbol,10))
}
n=exp[cg,]
dim(n)
#差异基因热图
library(pheatmap)
annotation_col=data.frame(group=Group)
rownames(annotation_col)=colnames(n)
heatmap_plot <- pheatmap(n,show_colnames =F,
scale = "row",
#cluster_cols = F,
annotation_col=annotation_col,
breaks = seq(-3,3,length.out = 100)
)
heatmap_plot
#拼图
library(patchwork)
volcano_plot +heatmap_plot$gtable
# 3.感兴趣基因的相关性----
library(corrplot)
g = deg$symbol[1:10] # 换成自己感兴趣的基因
g
M = cor(t(exp[g,]))
pheatmap(M)
library(paletteer)
my_color = rev(paletteer_d("RColorBrewer::RdYlBu"))
my_color = colorRampPalette(my_color)(10)
corrplot(M, type="upper",
method="pie",
order="hclust",
col=my_color,
tl.col="black",
tl.srt=45)
library(cowplot)
cor_plot <- recordPlot()
# 拼图
load("pca_plot.Rdata")
plot_grid(pca_plot,cor_plot,
volcano_plot,heatmap_plot$gtable)
dev.off()
#保存
pdf("deg.pdf")
plot_grid(pca_plot,cor_plot,
volcano_plot,heatmap_plot$gtable)
dev.off()以上内容为自己学习生信技能树课程的学习笔记,GEO数据挖掘这部分内容实在是太多啦!笔记字数破万啦!兜兜转转写了一个星期才写完,写完回过头看才觉得应该把理论知识和代码分开来记录,后面的复杂数据分析部分就放在下一篇笔记吧~
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
