嚼槟榔下的空间转录+代谢景观改变
原创嚼槟榔下的空间转录+代谢景观改变
原创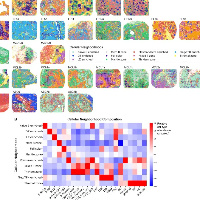
作者,Evil Gneius
槟榔大家熟悉吗?
嚼槟榔是一种在我国台湾、海南、广西等槟榔原产地都有的习俗,据统计,台湾约10%的人口有嚼槟榔习惯,而海南人嚼槟榔的比例达到38.42%,其中30至40岁人群更高达50.36%。地方的广泛食用,使嚼槟榔早已成为当地的一种文化。在南亚和东南亚,嚼槟榔的习惯也很普遍,这导致口腔粘膜下纤维化(OSF)。OSF是一种成熟的癌前病变,部分OSF病例最终发展为口腔鳞状细胞癌(OSCC)。
专家提醒,槟榔是世界卫生组织所列的一级致癌物。吃槟榔对健康不利,人们应戒除吃槟榔。有嚼食槟榔习惯的人如出现口腔内溃疡久治不愈、口腔黏膜有白色及暗斑等征兆,应及时到医院检查以排除癌变可能。
2022年6月,因参加《快乐男声》并正式出道的歌手傅松,为了劝诫网友不要再吃槟榔,在自己发布的视频中向网友展示自己因贪嚼槟榔而罹患口腔癌并溃烂的左脸。 2022年9月10日傅松去世,年仅36岁。他的朋友在发文悼念他时说:“愿他一路走好,愿他在另外一个世界,再没有槟榔,没有痛苦,没有癌症。
槟榔到底带给了口腔什么样的危害??
口腔鳞状细胞癌(OSCC)是最常见的头颈部癌症之一。2020年,全球有37万多例OSCC确诊病例,其中17万多例死亡。这些病例中有30%以上发生在南亚和东南亚,在这些地区,嚼槟榔是导致OSCC高发的一个重要危险因素。在中国,湖南、海南等省份人口较多,尤其是男性,长期有嚼槟榔的习惯,导致OSCC患病率较高。
长时间咀嚼槟榔可导致口腔粘膜下纤维化(OSF),临床表现为广泛的白色纤维网,瘢痕样形成,伴有口腔黏膜烧灼感,进行性张嘴受限和牙关紧闭。病理表现为上皮细胞萎缩、增生异常、成纤维细胞活化、胶原合成过度,炎症细胞浸润。此外,OSF是一种成熟的癌前病变,一些OSF最终发展为OSCC。这一过程本质上涉及长期的慢性不溶解性炎症,诱导上皮细胞的恶性转化,导致各种恶性生物表型的获得,包括增殖、侵袭、迁移和免疫逃避。
来看看研究成果
The ST Profiles of OSCC Reveal Intratumor Heterogeneity
- 样本:4例临床诊断为OSF的OSCC患者的新鲜组织样本
- 测序策略:邻片测空间转录 + 空间代谢
- HE图片显示样本的临床特征,组织区域。
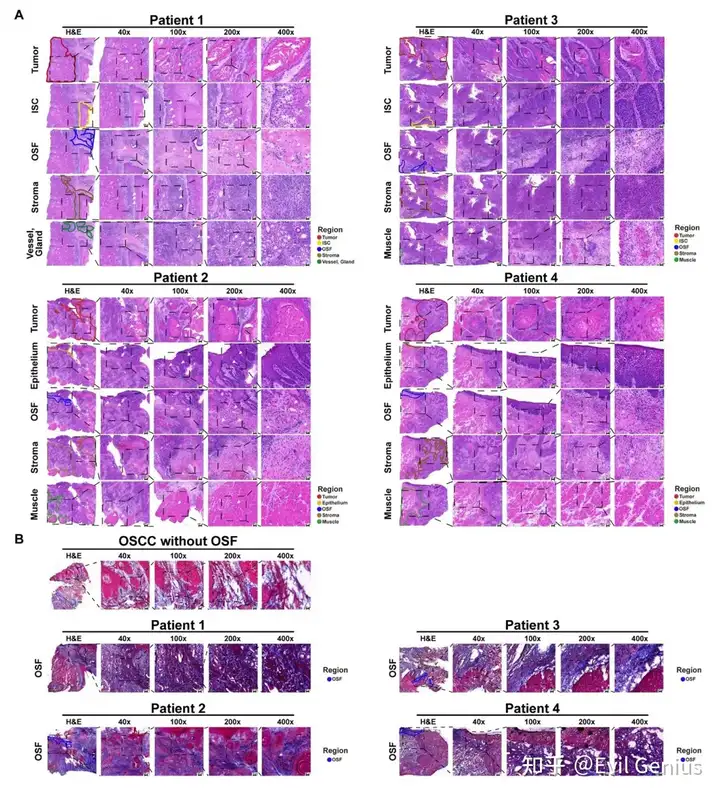
选取1个OSCC样本作为对照(男性,66岁,吸烟50年,每天2.5包,饮酒47年,每天250 mL,从不咀嚼槟榔,pT3N1M0临床分期为III期),无咀嚼槟榔史,无OSF表型。结果显示,在所有OSF来源的OSCC样本中,OSF区域均可见明显的胶原纤维沉积,而在对照样本中,肿瘤下方和邻近上皮组织未见胶原沉积。
- 10X Visium 的数据分析


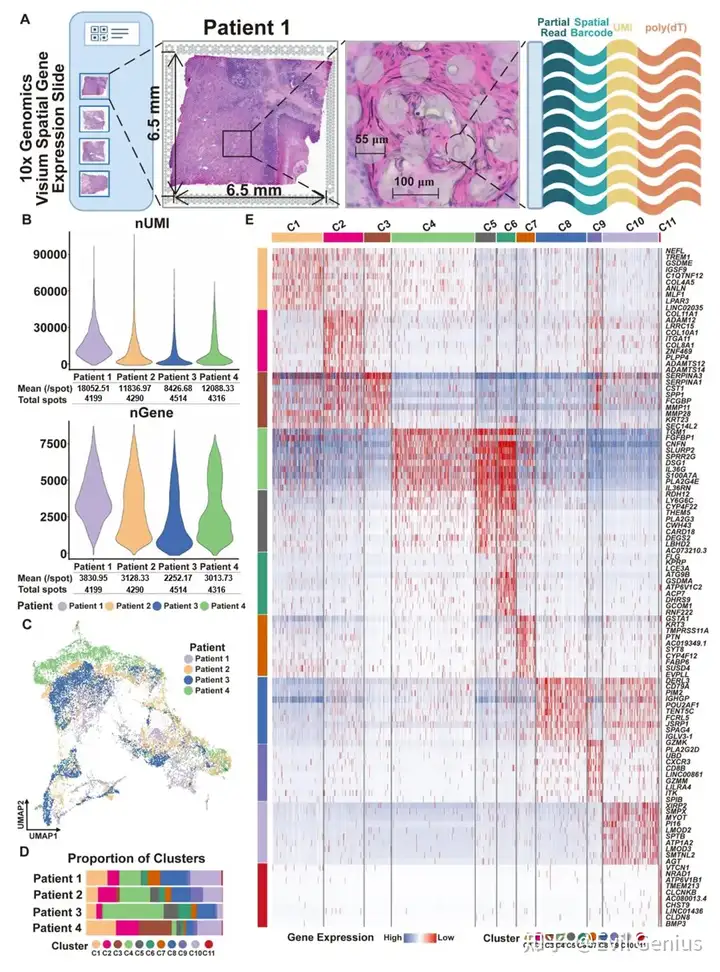
空间转录组的注释方法
- 形态学注释:例如根据组织切片上各SPOT的空间分布,主要位于肿瘤区域的1 ~ 4 cluster(c1 ~ c4)被归类为肿瘤亚型,位于邻近上皮区域的5 ~ 7cluster(c5 ~ c7)被归类为邻近上皮亚型。淋巴细胞浸润区域的cluster8 (C8)和cluster9 (C9)被认为是免疫亚型;cluster10 (C10)和cluster11 (C11)位于富含胶原、肌肉纤维和血管的基质区,被确定为基质亚型。
- Marker Gene注释(注意这里是注释生物学特征):根据前10个显著差异表达的标记基因注释了每个聚类的生物学特征,揭示了亚型之间的转录相似性。
- 单细胞空间联合分析,这里面采用了SPOTlight
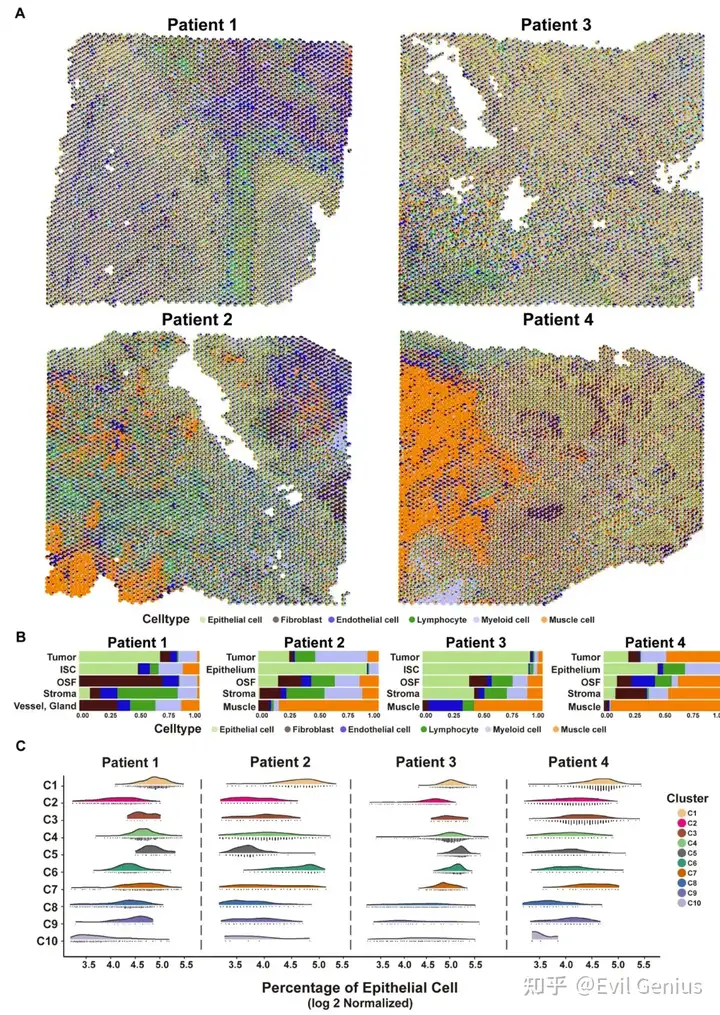
恶性上皮细胞的时空演化
计算了不同SPOT对应的上皮细胞比例,发现上皮细胞主要出现在C1-C7的恶性上皮区.
为了探讨OSF来源的OSCC在恶性转化过程中的时空转录组学特征,在C1-C7中选择了5,632个SPOT(代表肿瘤和邻近上皮细胞)。轨迹分析采用了monocle2.而由于没有上皮细胞分布,C8-C10被排除在随后的轨迹分析之外。分析构建了OSCC的恶性进展轨迹。其中,OSCC(前分支)发生在邻近上皮或ISC区域(C5-C7的SPOT)和C4,具有显著的分化能力。随后,基于转录谱的差异,该轨迹分化为两个分支(分支1和分支2)。C1和C2分布在分支1和分支2,代表了OSF衍生的OSCC两个进化方向的潜在共同特征。C3和C4对支系1和支系2的进化方向起决定性作用。
为了进一步探讨OSF来源的OSCC恶性发展轨迹的时间和功能差异,对沿两个分支的SPOT上的差异表达基因进行注释。前分支主要表现为上皮细胞生长、分化和角化的生物功能(如KLK10、KLK12、KRT8、EVPL、SLURP2)。此外,还观察了参与花生四烯酸和氨基酸代谢等代谢途径的基因(如PLA2G4E、ALOX12B、ODC1)。在分支1中,肿瘤细胞表现出细胞周期和翻译基因(如CDC20、EGFR)以及某些代谢基因(如甲基转移酶NNMT、载脂蛋白APOE)的显著富集,而分支2中的肿瘤细胞主要与干扰素反应相关(如ISG15、HLA-A、IFIT3、OAS2)。有趣的是,分支1和分支2均表现出与细胞外基质重塑相关的基因的显著表达(分支1:ECM受体相互作用,如FN1、COL16A1、VIM、NOTCH1;分支2:胶原形成,如COL17A1, CSPG4),提示分支1和分支2中EMT是OSF源性OSCC的共同终端表型。
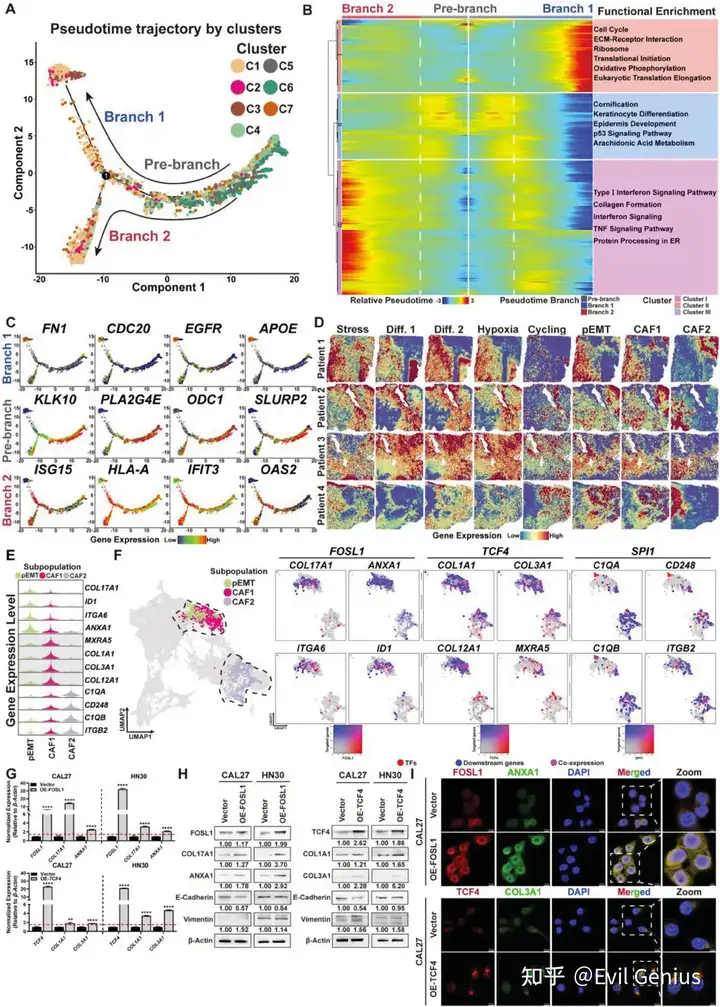

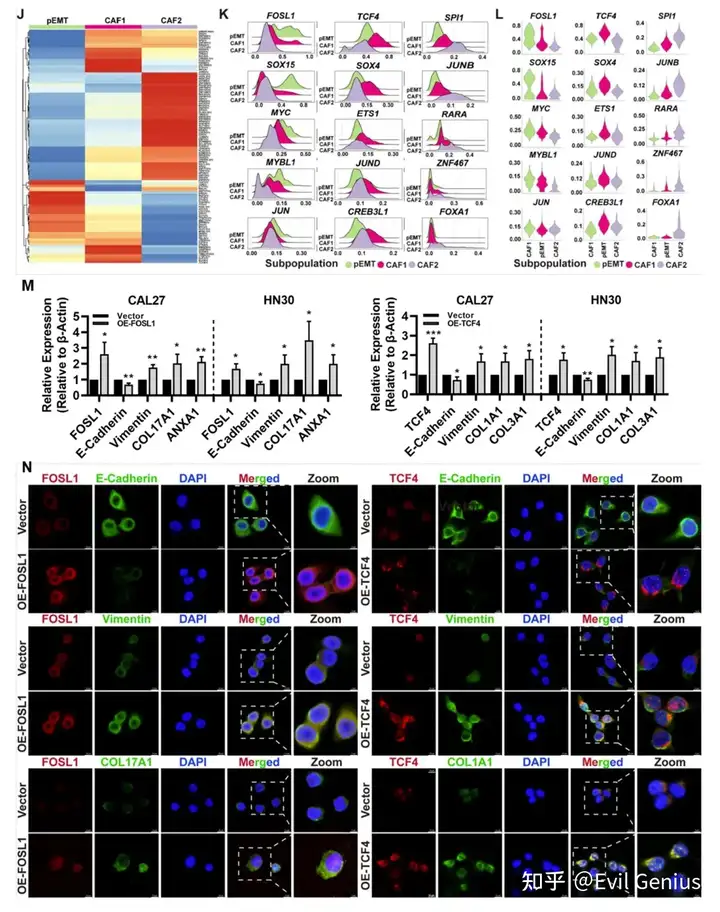

EMT是恶性上皮细胞获得间充质表型的动态过程。在这一过程中,pEMT细胞同时表现出上皮细胞和早期间充质细胞的特征,被认为是多种肿瘤侵袭和迁移的先导细胞。CAF1在转录模式和空间分布上与pEMT相似,但与CAF2存在显著差异,这表明CAF1代表了C2中经历EMT并获得成纤维细胞(间充质)样表型的肿瘤细胞亚群,而CAF2是由OSCC细胞诱导和募集的邻近非癌组织中的CAF2。为了进一步验证这一假设,我们对具有ppt、CAF1和CAF2特征的点进行了无监督主成分分析(PCA)。PCA结果显示,pEMT细胞更接近CAF1细胞,而CAF2则表现出显著的转录差异。对三种细胞类型进行差异表达基因(DEG)分析和生物过程基因本体富集(GO: BP)。结果发现,pEMT和CAF1细胞均显著表达间充质标志物(pEMT: PRSS23、COL17A1、SERPINE1、ITGA6;CAF1: POSTN, FN1, COL1A1, COL2A1)。与CAF1中胶原纤维和细胞外基质的活化组织相比,CAF2表现出与补体活化和体液免疫(例如C3, CXCL12, PLA2G2A, PTGDS)等免疫反应相关的独特DEG。这些发现与之前在其他肿瘤中发现的抗原呈递癌相关成纤维细胞(apCAFs)的转录特征一致。
总之,分析确定了OSF衍生的OSCC从ISC到pEMT的恶性转化伪时间轨迹,并最终获得了类似于CAF的表型。同时,发现肿瘤微环境中的癌症相关成纤维细胞(CAF2)能够加剧免疫反应的激活,表明它们参与肿瘤免疫微环境的重塑和延续。
OSCC中免疫细胞分布和细胞-细胞相互作用模式
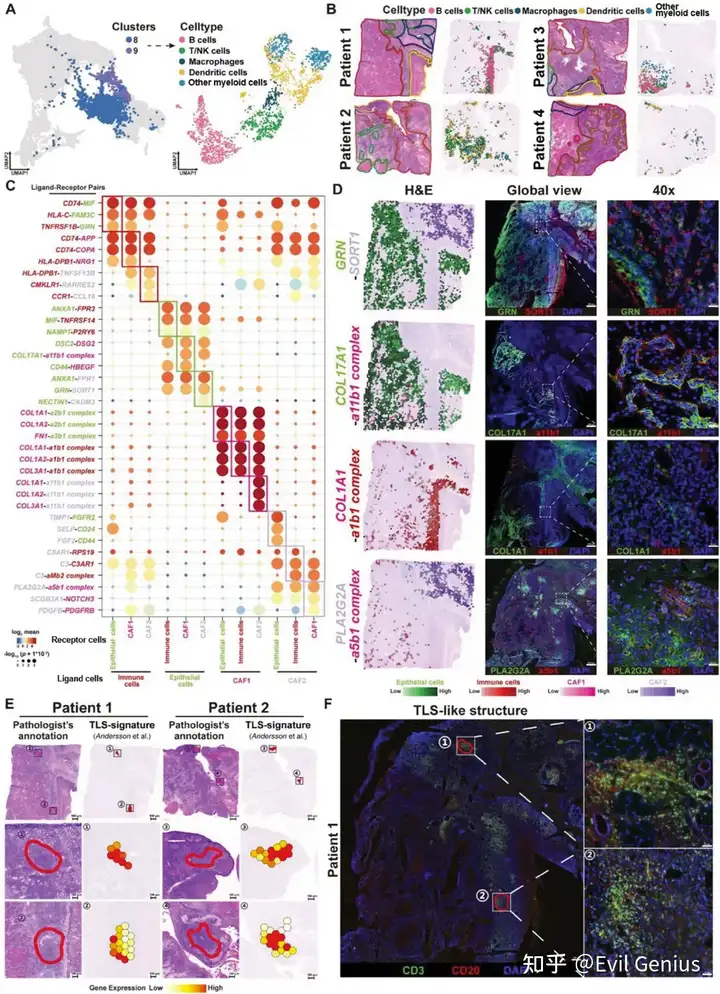
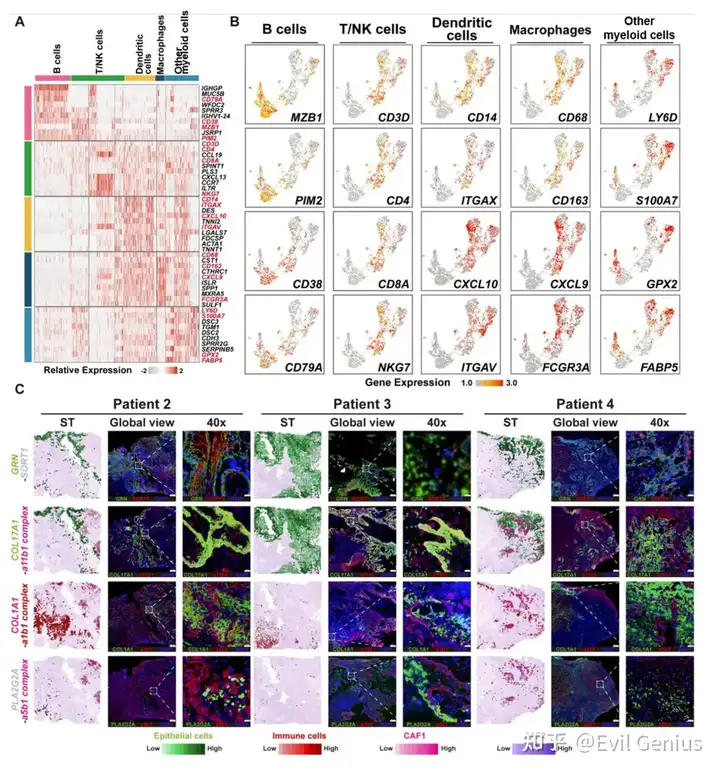
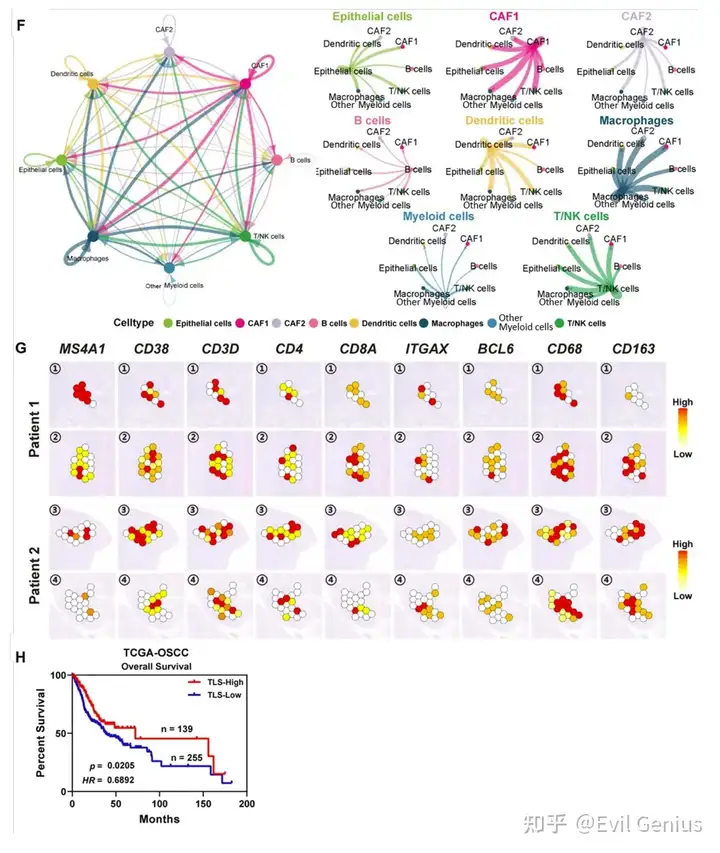
OSF和OSCC均以广泛的免疫细胞浸润为特征。然而,不同的免疫细胞在OSF来源的OSCC进展中的具体作用仍然是未知的。因此,首先表征了OSF来源的OSCC组织中各种类型免疫细胞的ST特征。从免疫亚型中共提取了1911个淋巴细胞(C8)和髓样细胞(C9),并通过无监督聚类分析将其分为B细胞、T/NK细胞、巨噬细胞、树突状细胞和其他髓样细胞(无法归类为任何特定髓样细胞类型的细胞)。分析这五种细胞类别中十个特征基因的表达水平,并检查了不同免疫细胞亚群中选定基因的表达模式。我们的研究结果表明,B细胞(特征基因:MZB1、PIM2、CD38、CD79A)和T/NK细胞(CD3D、CD4、CD8A、NKG7)具有相对独特的表达谱。相比之下,树突状细胞(CD14、ITGAX、CXCL10、ITGAV)、巨噬细胞(CD68、CD163、CXCL9、FCGR3A)和其他髓系细胞(LY6D、S100A7、GPX2、FABP5)具有更相似的转录谱。
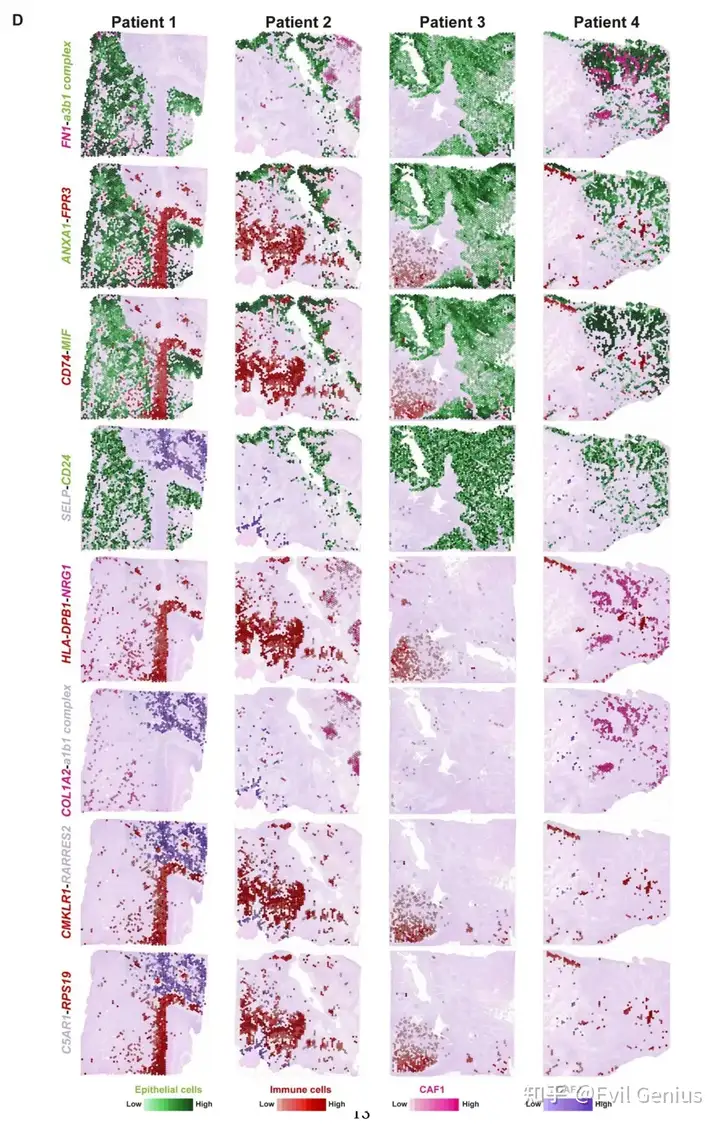
接下来,分析免疫亚型在组织切片上的分布模式,并观察到它们在基质区域和肿瘤区域内的显著聚集。这表明免疫细胞、肿瘤细胞和成纤维细胞之间存在相互作用。细胞表面的各种配体-受体相互作用在细胞间的通讯和相互作用中起着至关重要的作用。利用配体受体分析算法CellPhoneDB,对四种类型的细胞(上皮细胞、免疫细胞、CAF1细胞和CAF2细胞)进行了配体-受体相互作用分析。分析共鉴定出739对显著相互作用的配体-受体对(means > 1, P value < 0.001)。并对显著的配受体的空间分布进行展示。
数据分析显示了OSF源性OSCC中免疫细胞分布和浸润的空间特征,并证实了在ISC-pEMT-CAF1恶性进展过程中上皮细胞、成纤维细胞和免疫细胞之间的细胞间相互作用。在OSF来源的OSCC中发现了TLSs,并验证了TLSs在预测预后方面的潜在价值。
SM图谱揭示OSF衍生的OSCC的代谢重编程(AFADESI-MSI platform)
空间代谢物注释
根据每个样本的组织病理学注释,选择了每个区域内10个差异最显著的m/z信息,证实了组织区域间显著的代谢差异。恶性上皮区氨基酸代谢活跃,多种氨基酸代谢途径汇聚于多胺代谢,主要涉及精氨酸和脯氨酸。此外,OSF和基质区在半乳糖代谢、脂质代谢等途径中富含多种代谢物,and ABC transporters。
Warburg效应是肿瘤细胞获取能量的主要形式之一,它涉及肿瘤微环境中细胞间对碳水化合物的代谢竞争。OSF源性OSCC中,恶性上皮区葡萄糖含量(m/z 215.0317)明显低于OSF和间质区。然而,葡萄糖的代谢产物,如氧化葡萄糖酸或半乳糖醛酸(m/z 195.0511),以及柠檬酸循环的中间代谢物,如苹果酸(m/z 133.0143),在恶性上皮区域显著积累。这与肿瘤细胞大量消耗葡萄糖和快速代谢的特点是一致的。此外,这些代谢物也有助于肿瘤微环境的亚酸性。其他碳水化合物代谢中的差异代谢物,如半乳糖、山梨糖、果糖、甘露糖、塔格糖、肌醇和allose,具有相同的m/z比(m/z 215.0317),并且无法通过AFADESI-MSI进行区分,这是目前空间代谢组学研究中非靶向质谱法的局限性。
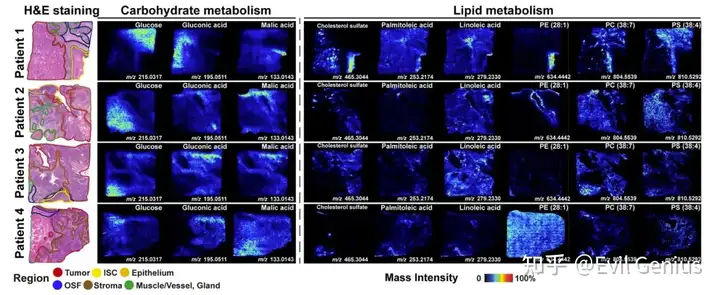
脂质代谢是肿瘤细胞满足其高能量需求的另一个重要代谢途径,包括脂肪酸代谢、胆固醇代谢和磷脂代谢。脂肪酸 -oxidation是肿瘤细胞中各种脂肪酸分解和能量供应的关键反应。在OSF衍生的OSCC中,观察到恶性上皮区域中单不饱和脂肪酸棕榈油酸(m/z 253.2174)和必需脂肪酸亚油酸(m/z 279.2230)水平较高,这表明OSF衍生的OSCC细胞能够通过脂肪酸 -oxidation获得能量,以满足其恶性进展过程中的高代谢需求。酰基辅酶a代谢物,以乙酰辅酶a为代表,是脂肪酸 -oxidation在线粒体中的重要产物,也参与多种代谢途径,包括胆固醇的生物合成。分析发现,鳞状细胞癌的典型代谢物硫酸胆固醇(m/z 465.3044)在OSF来源的OSCC的恶性上皮区有特异性的积累和分布,这可能与肿瘤细胞分化和抑制免疫细胞的浸润和活化有关。磷脂是细胞膜系统的重要组成部分,肿瘤细胞内的磷脂代谢作为肿瘤治疗的潜在靶点而备受关注。结果表明,磷脂酰乙醇胺(PE (28:1), m/z 634.4442)在相邻上皮和ISC区域具有较高的丰度,磷脂酰胆碱(PC (38:7), m/z 804.5539)和磷脂酰丝氨酸(PS (38:4), m/z 810.5292)在基质和OSF区域显著富集。这表明OSF衍生的OSCC在恶性进展过程中经历了磷脂代谢重编程,以满足有丝分裂期间细胞膜系统对磷脂生物合成的增加需求。 氨基酸代谢在代谢活性和蛋白质生物合成中起双重作用,与正常上皮细胞相比,肿瘤细胞对氨基酸的需求和消耗要高得多。在osf源性OSCC中,氨基酸代谢物如天冬氨酸(m/z 133.0303)、瓜氨酸(m/z 198.0850)、精氨酸(m/z 175.1189)、亚精胺(m/z 146.1652)和精胺(m/z 203.2230)在恶性上皮区明显积累,表明osf源性OSCC具有活跃的多胺代谢和代谢重编程特征。
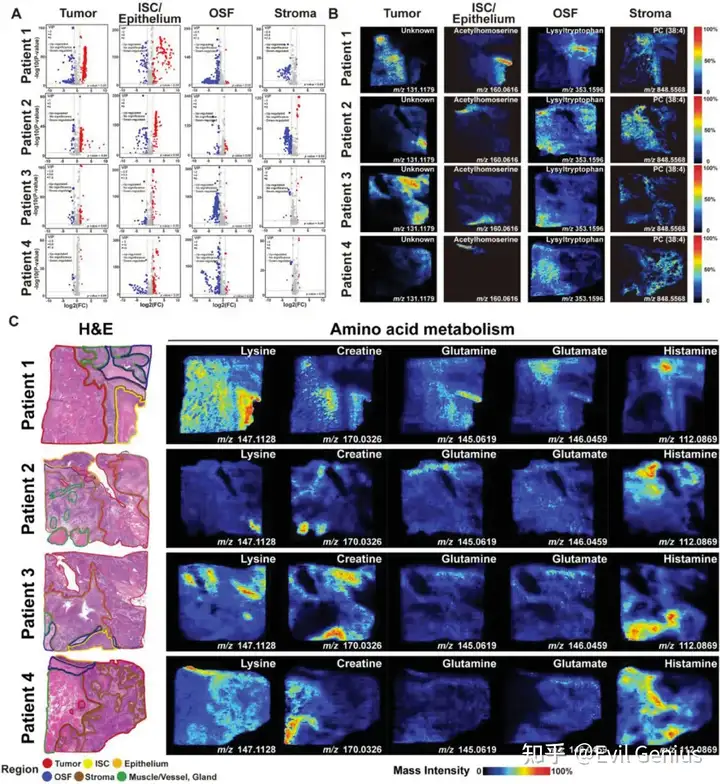
活跃的多胺代谢是osf衍生的OSCC的代谢标志
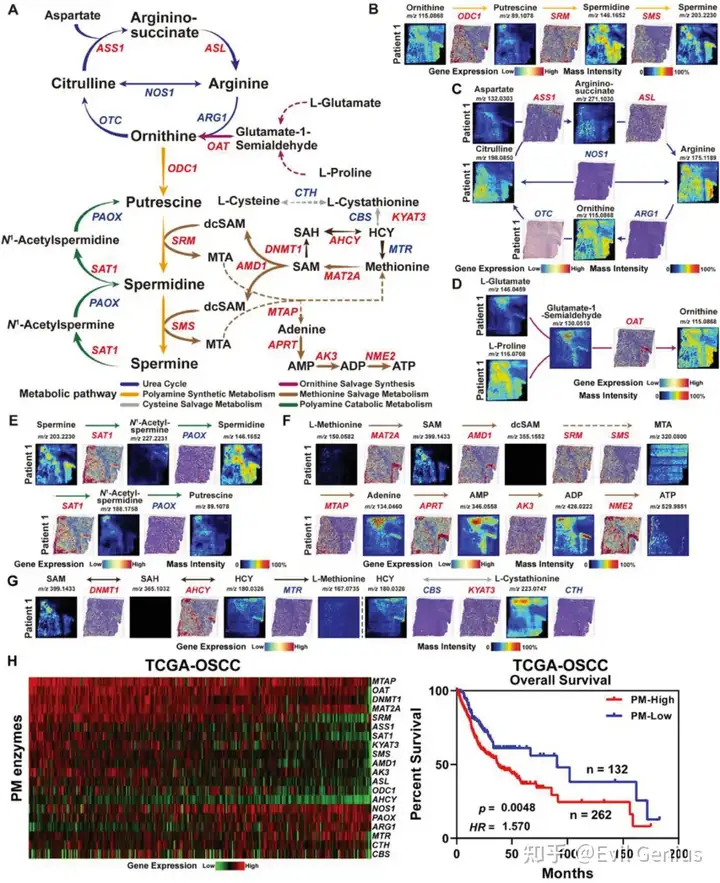
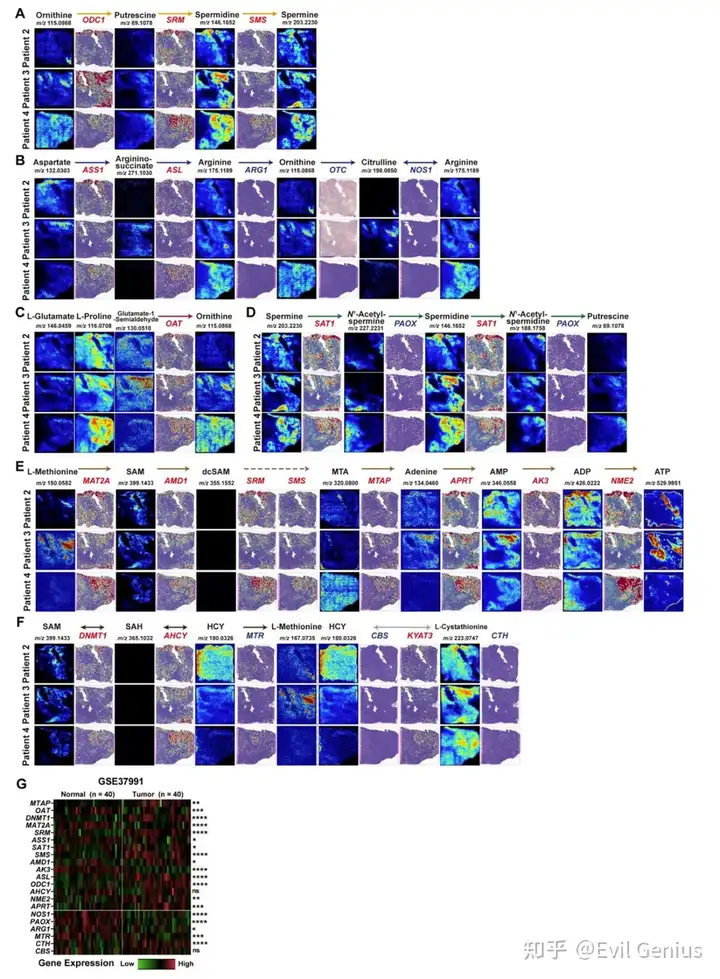
多胺代谢是人体重要的含氮代谢途径之一。多胺代谢异常不仅影响肿瘤细胞内代谢通量的调节,还通过参与细胞内表观遗传修饰,广泛影响细胞存活和增殖等多种恶性生物过程。通过整合ST和SM数据,发现OSF源性OSCC的多胺代谢通量中,代谢产物腐胺、亚精胺和精胺及其相关酶鸟氨酸脱羧酶1 (ODC1)、亚精胺合酶(SRM)和精胺合酶(SMS)在肿瘤区域具有特异性分布。这表明异常的多胺代谢是osf来源的OSCC中一个突出的代谢表型,并可能在口腔上皮的恶性进展中起驱动作用。
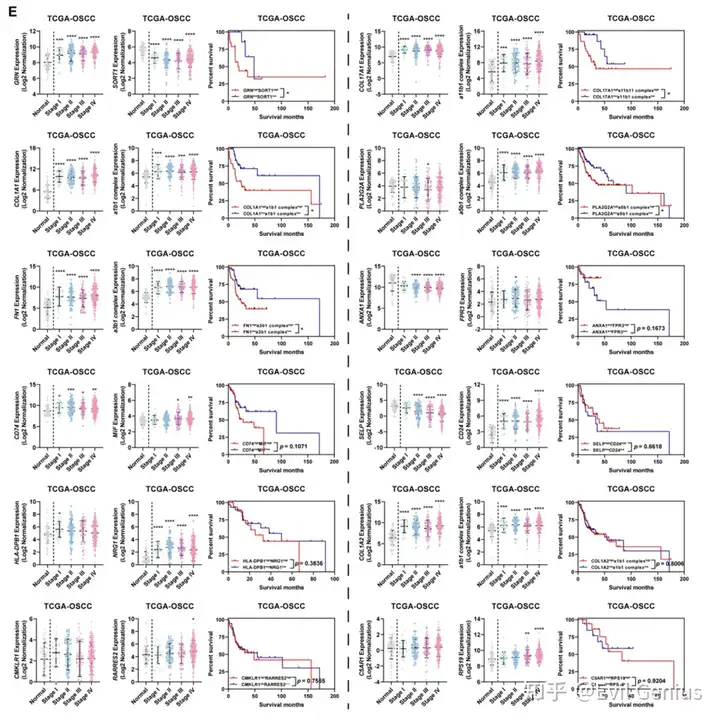
最后,验证了23种多胺代谢酶(PM酶)的表达与OSCC预后的功能相关性。通过分析TCGA中OSCC患者的RNA-seq数据,发现多胺代谢酶的高表达与患者预后较差相关,这与之前关于多胺代谢促进肿瘤发展的报道一致。总之,研究结果共同表明,活跃的多胺代谢是OSF来源的OSCC的一个重要代谢特征,其代谢重编程可能导致OSCC的不良预后事件。
结论
槟榔是最受欢迎的成瘾性物质之一,全世界约有6亿人咀嚼各种形式的槟榔制品。咀嚼槟榔是OSF的一个众所周知的危险因素,临床上表现为进行性张嘴受限,严重影响生活质量。在OSF的发展过程中,过度活化的成纤维细胞与免疫细胞、上皮细胞相互作用复杂,最终导致“炎-癌”恶性转化,发生OSCC。然而,与其他癌前病变(如口腔白斑)不同,OSF引起的OSCC的各种亚型尚未明确,其恶性进展过程中的关键分子事件仍不清楚。
通过ST分析,阐明了OSF源性OSCC中肿瘤细胞的分子亚群和异质性。分析目标是通过对这些细胞进行伪时间分析来探索OSCC发展的过程和模式。癌症基因组图谱网络先前基于传统的bulk RNA-seq数据提出了HNSCC的分子亚群标准。它将HNSCC分为经典亚型、非典型亚型、间充质亚型和基础亚型,它们在氧化应激、细胞死亡和先天免疫反应方面表现出明显的差异。然而,由于bulk RNA-seq技术在解剖肿瘤微环境方面的局限性,它只能实现不同HNSCC患者活检组织样本的亚群分类。它不能在单细胞分辨率下揭示同一组织内肿瘤细胞的异质性或它们的进化模式。此外,由于scRNA-seq数据缺乏空间信息,前人的研究没有进一步研究肿瘤细胞不同亚群CAF1和CAF2细胞的起源、进化关系、生物学特性和空间相互作用。基于上述细胞亚群标准,提出了一种新的OSF衍生的OSCC恶性转化过程模型,称为“ISC-pEMT-CAF样表型”,该模型表明在肿瘤发生早期,肿瘤细胞表现出活跃的增殖和分化能力,并伴有应激和缺氧特征。在向浸润性癌发展的过程中,HNSCC细胞在增殖、翻译和免疫应答方面开始表现出功能上的差异。有趣的是,晚期OSF来源的OSCC表现出显著的细胞外基质重塑能力,其特征是EMT相关基因表达升高,胶原沉积增加,类似成纤维细胞样功能。这表明OSF衍生的OSCC可能通过发挥肿瘤表型可塑性诱导肿瘤细胞获得成纤维细胞样功能。
成纤维细胞是肿瘤微环境的核心组成部分,其与肿瘤细胞和免疫细胞的相互作用可影响肿瘤增殖、侵袭和免疫逃避等多种恶性表型。pEMT细胞表现出上皮和间充质标志物的活跃表达,位于肿瘤和邻近基质的前沿,通常被认为是肿瘤侵袭和转移的“先驱者”。在osf衍生的OSCC中,我们发现CAF1代表了一组经历了完全EMT并获得了类似于CAF1表型的细胞。它们主要分布在肿瘤和基质区之间的边缘,具有更活跃的细胞外基质重塑能力。同时,CAF2代表由肿瘤细胞募集诱导的肌成纤维细胞样细胞。它们主要位于基质和OSF区域,并表现出免疫活性,如补体激活和先天免疫反应。它们的功能更符合炎性癌症相关成纤维细胞,尤其是apcas的特征。pEMT、CAF1和CAF2细胞通过表达各种tf如FOSL1、TCF4和SPI1,经历了从上皮角化到细胞外基质重塑和免疫应答调节的转变。肿瘤细胞与CAF1细胞之间的相互作用涉及COL17A1/a11b1复合物等配体-受体对,它们共同促进pEMT肿瘤细胞向CAF1样细胞的转化。此外,CAF1细胞通过COL1A1/a1b1等配体受体对与多种免疫细胞相互作用,导致免疫细胞的粘附和浸润限制,从而协助osf源性OSCC的免疫逃逸。然而,尽管在肿瘤细胞、CAF1和CAF2细胞中存在显著表达的配体受体对(如GRN/SORT1、PLA2G2A/a5b1复合体),但CAF1和CAF2细胞之间缺乏空间接近性。相反,免疫细胞和CAF2细胞具有空间距离和表达配体-受体对的可行性。我们推测,CAF2细胞更可能通过C5AR1/RPS19、C3/C3AR1和C3/aMb2复合物等配体受体对与基质区免疫细胞相互作用,从而协同构建osf源性OSCC独特的免疫微环境特征。
代谢重编程是肿瘤恶性发展的一个重要标志。在OSF衍生的OSCC恶性进展的背景下,观察到与脂质代谢(PLA2G2E, APOE),氨基酸代谢(ODC1)和葡萄糖代谢(LDHA)相关的关键酶分子的特定表达模式。为了深入研究osf源性OSCC微环境中的代谢重编程特征及其与肿瘤恶性进展的相关性,我们首次利用AFADESI-MSI技术获得了空间代谢组学图谱。我们的研究结果显示,与癌旁基质和OSF组织相比,肿瘤区域的葡萄糖含量显著降低,葡萄糖代谢物表现出显著的聚集。这证实了osf衍生的OSCC广泛利用和消耗葡萄糖。CAF中葡萄糖含量的升高作为肿瘤生长的“土壤”,提示CAF和肿瘤细胞可能共同调节肿瘤微环境中的葡萄糖代谢,从而促进肿瘤的发展。脂质代谢是肿瘤细胞获取能量的另一重要途径。在osf衍生的OSCC中,我们的观察表明,肿瘤细胞倾向于通过脂肪酸 -oxidation途径获取能量,这与其他肿瘤的研究结果一致。
氨基酸代谢是肿瘤微环境中重要的氮代谢途径,肿瘤经常进行氨基酸代谢重编程以满足增加的氮代谢需求。自列文虎克于1678年首次发现精胺以来,多胺代谢一直被认为是细胞内氮代谢的重要组成部分。细胞内多胺池水平的升高在肿瘤细胞的恶性增殖和生长中起重要作用。细胞内多胺的合成始于鸟氨酸,一种不参与蛋白质形成的氨基酸。在osf衍生的OSCC中,我们发现参与多胺合成的尿素循环被显著抑制,肿瘤微环境更多依赖谷氨酰胺-天冬氨酸途径补充鸟氨酸。先前的研究也报道了在各种上皮源性肿瘤中抑制鸟氨酸合成所需的尿素循环。由于其独特的多阳离子结构,多胺可以通过静电结合、诱导翻译后假设修饰、激活特定信号通路等多种机制发挥表观遗传调控功能。越来越多的证据表明,多胺还可以调节肿瘤微环境中免疫细胞的命运。在osf来源的OSCC中,我们观察到多胺水平与免疫细胞浸润呈负相关,为多胺在免疫抑制微环境中的重要作用提供了空间证据。尽管目前有许多成熟和安全的多胺合成酶抑制剂(如ODC抑制剂DFMO),甚至多胺阻断治疗的I期临床试验(NCT03536728)正在进行中(如AMXT 1501+DFMO),但应该承认,免疫微环境的复杂性仍然是多胺代谢阻断方法有效性的主要限制因素。近年来,越来越多的研究关注通过阻断多胺代谢来实现“冷”肿瘤的代谢重编程,从而有效增强肿瘤微环境中的免疫应答。考虑到口腔微生物群的代谢调节作用,有必要进一步研究微生物群介导的多胺代谢在上皮源性肿瘤发生和免疫逃避中的具体机制。
此外,在OSF衍生的OSCC肿瘤微环境中,部分配体-受体对不仅在诱导各种类型的细胞相互作用中发挥通讯功能,而且在协同激活多种代谢过程中发挥作用。例如,CD74可能通过与上皮细胞上的受体MIF分子结合,可能通过激活下游葡萄糖分解代谢,从而影响肿瘤组织区域内的葡萄糖代谢水平。肿瘤细胞表面的GRN通过与免疫细胞(Treg细胞)表面的TNFRSF1B受体相互作用,激活Treg细胞内的糖酵解过程,导致免疫细胞浸润的间质区葡萄糖消耗增加,乳酸积累升高。免疫细胞膜分子CMKLR1与CAF2细胞表面受体RARRES2相互作用后,激活CAF2细胞的脂质代谢,导致成纤维细胞聚集体的间充质区和OSF区积累大量脂质相关代谢物
参考文章Spatial Transcriptomic and Metabolomic Landscapes of Oral Submucous Fibrosis-Derived Oral Squamous Cell Carcinoma and its Tumor Microenvironment(Advanced Science,IF 15)
生活很好,有你更好
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。
原创声明:本文系作者授权腾讯云开发者社区发表,未经许可,不得转载。
如有侵权,请联系 cloudcommunity@tencent.com 删除。