文献分享——乳腺癌肝和脑转移瘤内异质性的单细胞景观和免疫抑制微环境
文献分享——乳腺癌肝和脑转移瘤内异质性的单细胞景观和免疫抑制微环境
曾老师时不时会给我分享文献,在看文献的过程中就顺手把笔记写下来,正好可以作为推文分享出来。 这周的推文仍然是分享一篇文献——关于乳腺癌肝和脑转移瘤内异质性的单细胞景观和免疫抑制微环境。
文章信息:
文章题目:The Single-Cell Landscape of Intratumoral Heterogeneity and The Immunosuppressive Microenvironment in Liver and Brain Metastases of Breast Cancer. 期刊:Advanced Science 日期:2022 Dec 18 DOI:10.1002/advs.202203699

文章所用患者样本和数据集:
scRNA-seq
数据可用性声明:支持本研究结果的数据可根据合理要求从通讯作者处获得。
收集6例在中山大学肿瘤防治中心接受手术治疗的乳腺癌患者的肝或脑转移灶。本研究分析的所有样本均来自经病理确诊的转移性乳腺癌患者。从肿瘤区域获取用于scRNA-seq的标本,分离前切除肿瘤周围正常肝组织和脑组织。仅纳入转移性乳腺癌女性患者。年龄41 ~ 55岁,中位年龄50岁。新鲜肿瘤重量为150 ~ 300毫克。除患者BM01(经抗her2治疗和化疗后病理完全缓解)外,所有患者术前均未接受化疗或放疗治疗转移。
丰富的数据处理:数据经过上游分析后,QC质控,细胞类型注释,差异表达基因(DEG)分析,单细胞拷贝数变异(CNV)分析【采用inferCNV方法】; 富集【GO,KEGG,GSVA】;表达程序的鉴定:一致的非否定【矩阵分解(cNMF)算法】;采用Monocle 2算法进行拟时序分析;单细胞熵和细胞周期分析;细胞通讯分析。
bulk-RNA-seq
基因表达综合(GEO)数据库下载bulk转录组数据和相应的临床信息 (ID: GSE56493, GSE12276, GSE46141和GSE173661)。
摘要及简介:
远处转移仍然是乳腺癌发病的主要原因。与其他部位转移的患者相比,肝或脑转移的患者预后极差,抗pd -1/L1免疫检查点治疗的应答率较低。因此,迫切需要研究抗pd -1/L1耐药的潜在机制,并针对这些患者制定更有效的免疫治疗策略。
使用单细胞RNA测序,描绘了基于乳腺癌、肝和脑转移的 44473个细胞 的整个肿瘤生态系统的高分辨率图。scRNA-seq鉴定了乳腺癌肝和脑转移瘤的多种细胞类型,包括 癌细胞、淋巴细胞、髓样细胞、基质细胞和器官特异性常驻细胞 。经典型标志物鉴定并经多重免疫荧光染色证实,转移性生态系统具有显著的免疫抑制细胞重编程,如FOXP3+调节性T细胞、LAMP3+耐受性树突状细胞、CCL18+ m2样巨噬细胞、RGS5+癌症相关成纤维细胞和LGALS1+微胶质细胞。此外,PD-1和PD-L1/2分别在CD8+ T细胞和癌症/免疫/基质细胞中几乎不表达。免疫检查点分子LAG3-LGALS3和tikit - nectin2在CD8+ T细胞和肿瘤/免疫/基质细胞之间的相互作用在免疫逃逸中起主导作用。
综上所述,本研究首次剖析了乳腺癌肝和脑转移瘤内异质性和免疫抑制微环境,为这些患者提供了最合适的免疫治疗策略。
结果:
乳腺癌肝、脑肿瘤生态系统以单细胞转录组为特征的转移测序
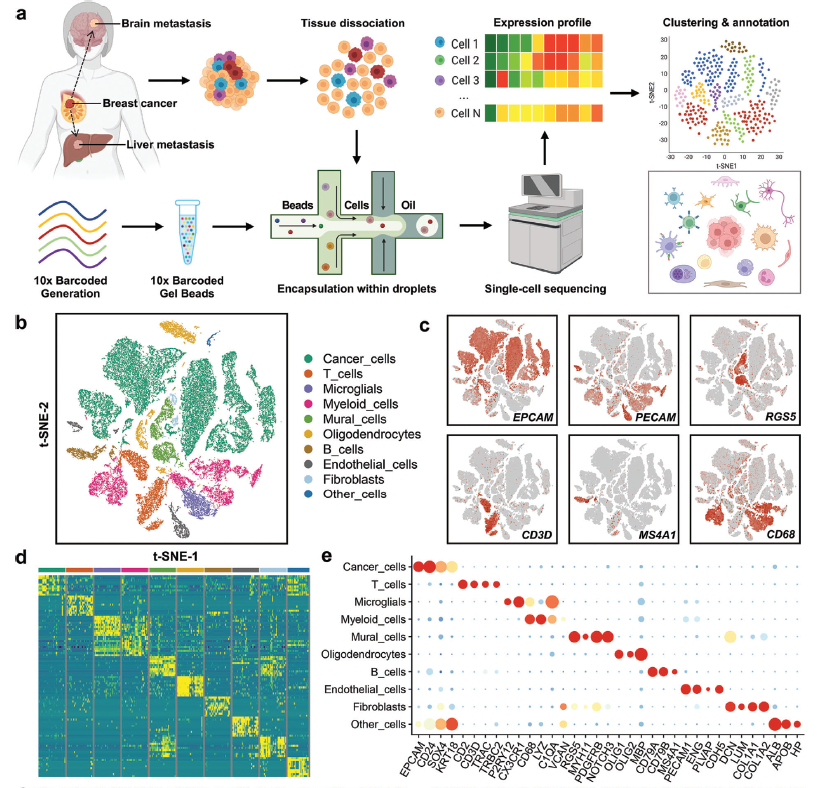
为了破译乳腺癌肝和脑转移灶肿瘤微环境中的细胞结构,对转移灶进行了单细胞rna测序。经过严格的质量控制过滤器和去除双重细胞后,共44473个细胞被鉴定并纳入后续分析。对于每个细胞,我们平均检测出约2,411个基因和9,799个UMI。然后,我们在Seurat包中进行了无监督聚类分析。图b为单细胞的t-SNE图,以主要细胞类型着色。c)上皮癌细胞(EPCAM)、内皮细胞(PECAM1)、壁细胞(RGS5)、T细胞(CD3D)、B细胞(MS4A1)、髓系细胞(CD68)的经典标志基因特征图。d) 乳腺癌肝、脑转移中10种主要细胞类型前10个差异表达基因表达水平的热图。e) 点阵图显示所有主要细胞类型中典型标记基因的表达水平。
六种常用表达通路识别乳腺癌、肝和脑转移性病变中的癌细胞
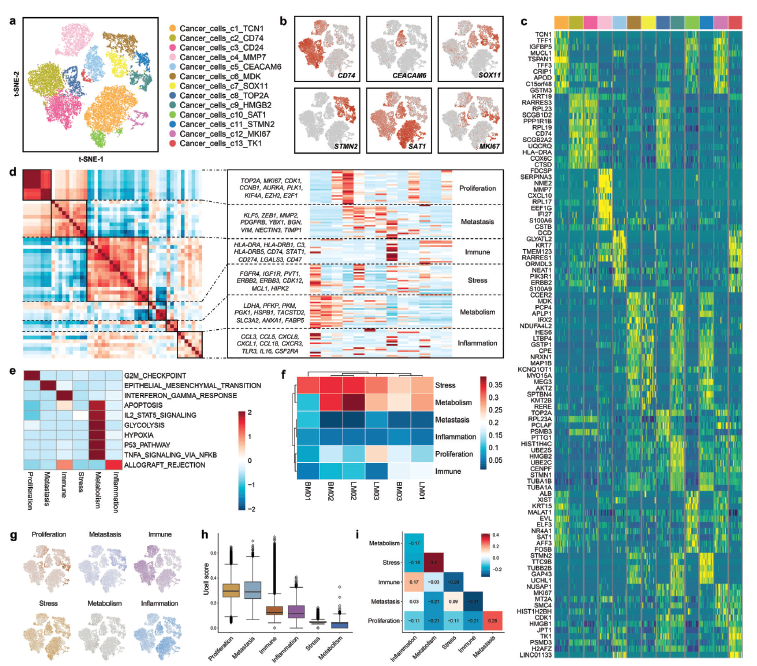
乳腺癌肝转移灶和脑转移灶癌细胞六种常见表达通路的鉴定。
包括增殖维持、转移激活、免疫逃避、应激抵抗、代谢重编程和炎症促进。【proliferationsustaining, metastasis activation, immune evasion, stress resistance,metabolic reprogramming, and inflammation promotion】
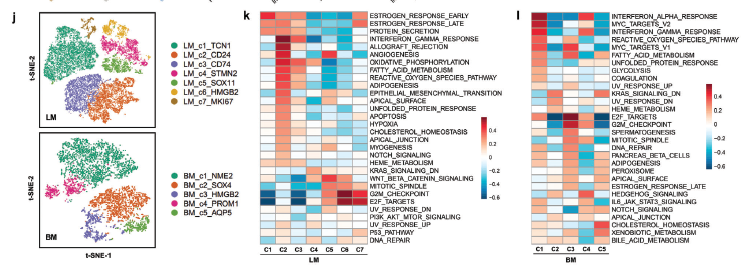
a) 癌细胞景观以簇着色的t-SNE图。b) 显示每个癌细胞亚簇中高表达基因归一化表达的特征图。c) 13个癌细胞亚簇中前10个差异表达基因表达水平的热图。d) 来自癌细胞基因表达谱的50个模块的成对相关性热图。六种常见的癌细胞表达程序被聚合成集群。e) 使用GSVA来比较每个程序的程序细胞和非程序细胞之间的通路差异。利用Z评分对各列进行标准化。f) 每个样本中所有6个表达式程序的标准化程序评分显示在聚类热图中。g) 每个表达式程序的分布。将每个程序中表达超过70%基因的细胞定义为程序细胞;否则,它们被定义为非程序细胞。h) 6个表达式程序中程序单元占比的箱线图,按程序得分中位数排序。i) 热图显示比值比作为每个表达式程序对(列和行)共现或排除的测量。j) 乳腺癌肝转移(LM)和脑转移(BM)中癌细胞的重新聚集。k,l) 基于标志基因集,通过GSVA评估7个肝转移癌细胞亚群的潜在生物学功能和相关信号通路以及5个脑转移癌细胞亚群的潜在生物学功能和相关信号通路
转移性乳腺癌细胞拷贝数变异(CNV)及克隆进化分析
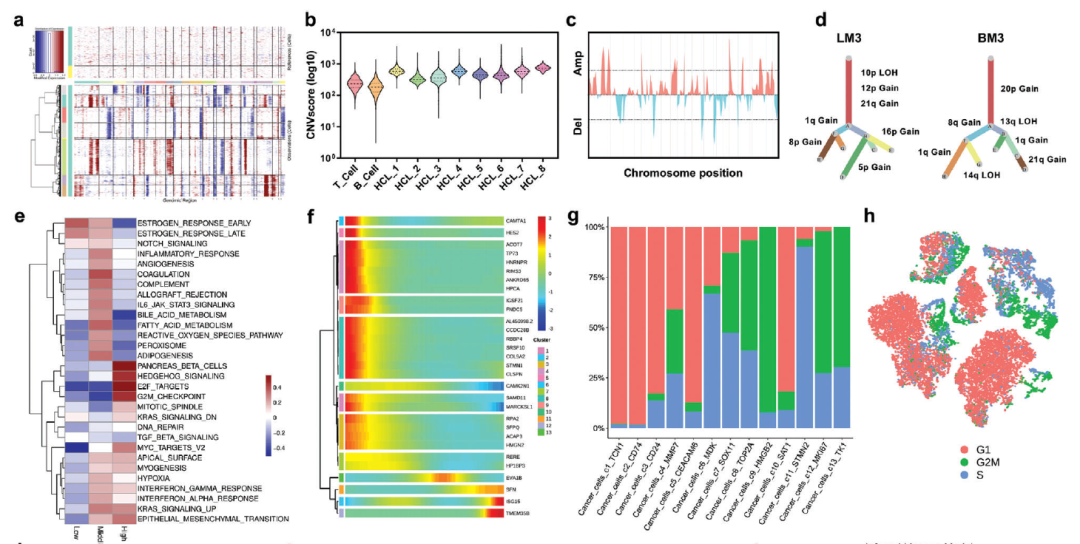
a)分级热图显示大尺度乳腺癌肝和脑转移的癌细胞和T/B细胞的CNVs。T/B细胞作为对照。b) 8个癌细胞簇(HCL1-8)被鉴定出具有相似的拷贝数改变。使用对数转换CNV评分将每个簇的CNV与T细胞和B细胞的CNV进行比较。c)根据每条染色体的跨越位置(x轴)推断CNVs。d)单个癌细胞的克隆树。分支是根据亚克隆中包含相应CNVs的细胞百分比来划分的。e) GSVA比较低、中、高CNV评分细胞通路的差异。利用Z评分对各列进行标准化。f)差异表达基因和假时间曲线以层次化热图表示。g)各细胞簇中G1期、G2M期和S期的癌细胞百分比。将G1期定义为非循环状态,G2M期和S期定义为循环状态。h) t-SNE图显示癌细胞处于G1、G2M、S期。
乳腺癌肝和脑转移中淋巴细胞和先天淋巴样细胞的分布
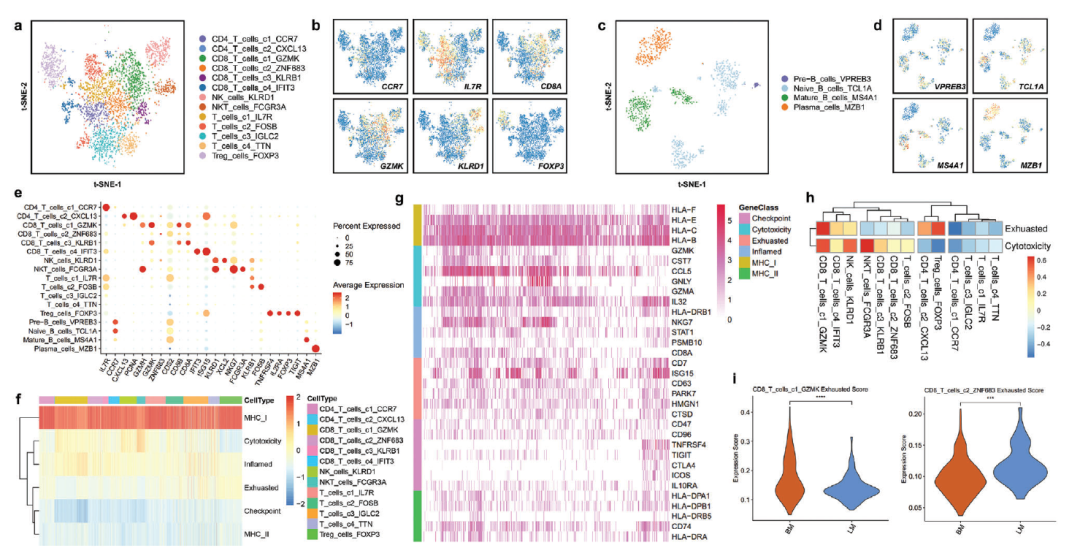
a) 以亚簇着色的T细胞和NK细胞景观的T - sne图。b) 各T细胞和NK细胞亚群中典型标志基因的标准化表达特征图。c) B细胞亚群着色的t-SNE图。d) 各B细胞亚簇中典型标志基因的归一化表达特征图。e) 所有淋巴细胞和固有淋巴细胞亚型中典型标记基因表达水平的点图。f) 根据GSVA显示每个T细胞和NK细胞的基因集评分的热图。基因集包括MHC分子、T细胞细胞毒性、T细胞耗竭、炎症通路、调节性细胞因子和免疫检查点通路集。g) 每个基因集中核心基因表达的热图。h) 每个T细胞和NK细胞簇的细胞毒性和功能障碍根据基因标签评分进行分析和量化。i) 乳腺癌肝、脑转移瘤 CD8_T_cells_c1_GZMK和CD8_T_cells_c2_ZNF683 耗竭评分。
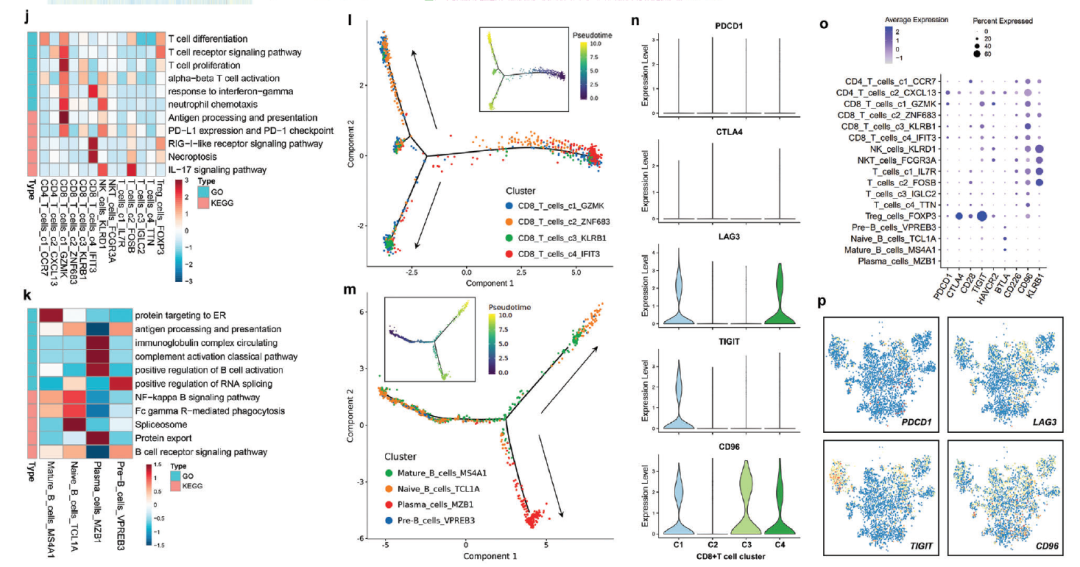
j,k) 通过GO和KEGG分析评估T、B和NK细胞亚群的潜在生物学功能和相关信号通路。l) 基因表达高度可变的CD8+ T细胞(CD8_T_cells_c1_GZMK, CD8_T_cells_c2_ZNF683, CD8_T_cells_c3_KLRB1和CD8_T_cells_c4_IFIT3)的拟时序分析。l) 拟时序轨迹分析具有高度可变基因表达的B细胞 (Pre-B_cells_VPREB3, Naive_B_cells_TCL1A, Mature_B_cells_MS4A1和Plasma_cells_MZB1)。n) 小提琴图,显示四个CD8+ T细胞亚群中免疫检查点基因的表达水平。o) 显示每个淋巴细胞和固有淋巴细胞亚群中免疫检查点基因表达水平的点图。p) 显示淋巴细胞和固有淋巴细胞中免疫检查点基因标准化表达的特征图。
肿瘤微环境中免疫抑制髓系细胞的特征
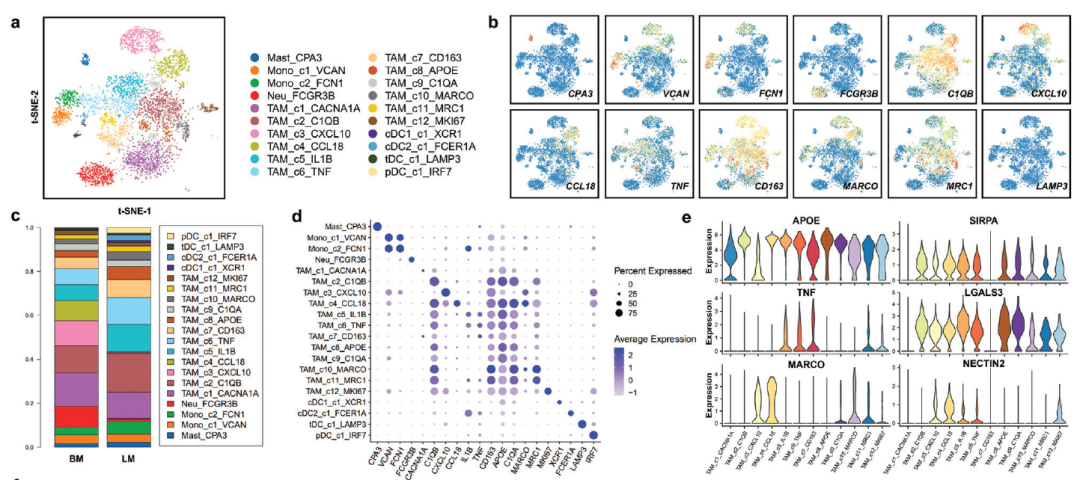
a) 骨髓细胞重新聚类,通过t-SNE图显示每个细胞亚型的轮廓。b) 显示每个髓系细胞中典型标记基因归一化表达的特征图细分聚类。c) 各髓系细胞簇在乳腺癌肝转移和脑转移中的相对比例。d) 所有髓系细胞亚型中典型标志基因表达水平的点图。e) 小提琴图,显示12个肿瘤相关巨噬细胞(TAM)亚群中巨噬细胞典型标志物(APOE)、M1巨噬细胞标志物(TNF)、M2巨噬细胞标志物(MARCO)、吞噬抑制分子(SIRPA)和免疫检查点基因(LGALS3和NECTIN2)的表达水平。
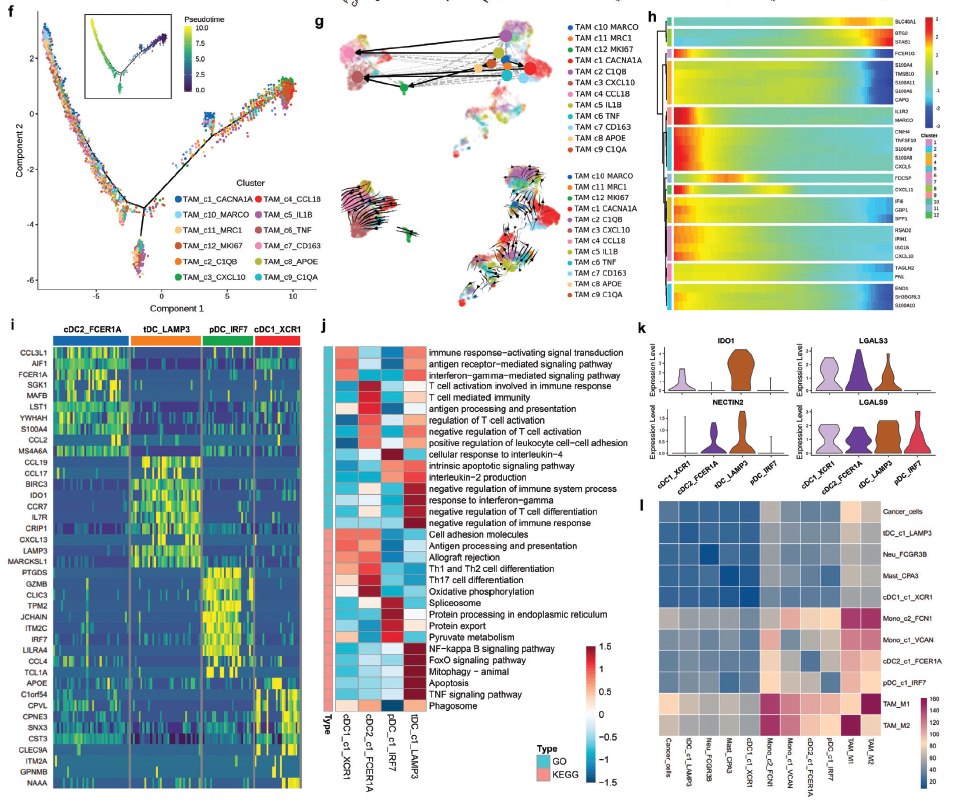
f) 基因表达高度可变的肿瘤相关巨噬细胞(TAMs)的拟时序轨迹分析。伪时间曲线上的每个点代表一个单元格,并根据其集群标签着色。g) RNA速度分析用于研究TAMs的发育谱系和细胞动力学。h) 差异表达基因和TAM拟时序曲线显示在分级热图中。i) 树突状细胞(dc) 4个亚簇中前10个差异表达基因表达水平的热图。j)通过GO和KEGG分析评估各DC亚簇的潜在生物学功能和相关信号通路。k) 小提琴图显示免疫抑制基因(IDO1)和免疫检查点基因(LGALS3, LGALS9和NECTIN2)在四个DC亚簇中的表达水平。l) 通过CellphoneDB 2方法预测的髓系细胞和癌细胞之间相互作用数量的热图。
癌症相关成纤维细胞的多样性肿瘤中的内皮细胞(ECs)和壁细胞(MCs)微环境
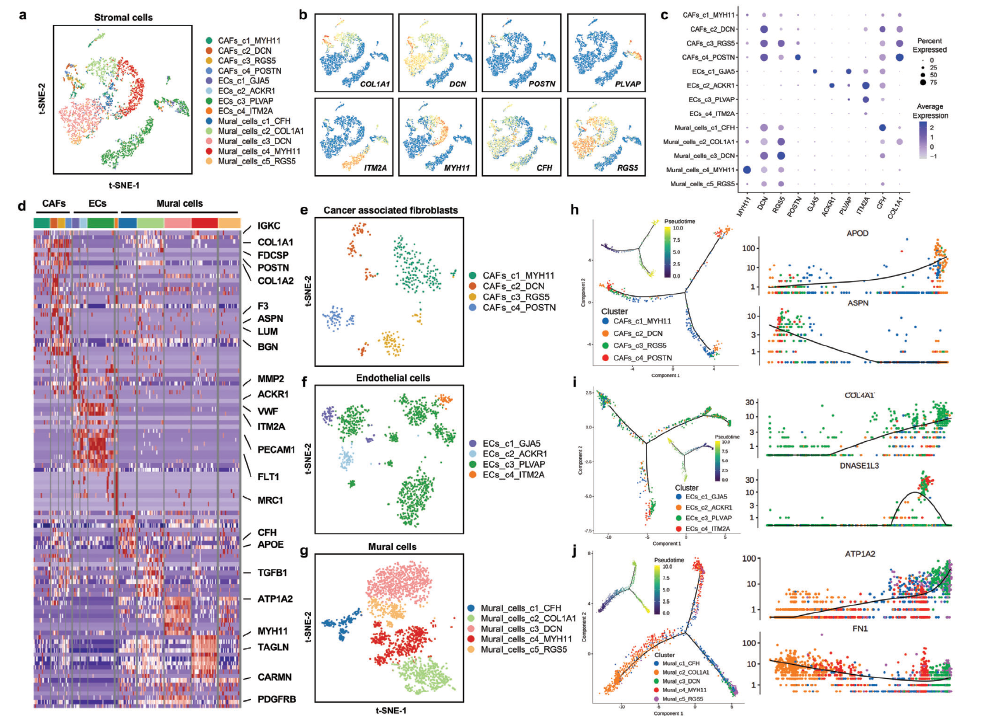
a) 以亚簇着色的基质细胞景观的t-SNE图。b) 各基质细胞亚簇中典型标志基因的归一化表达特征图。c) 各基质细胞亚型典型标志基因表达水平的点图。d) 4个基质细胞亚群间前10个差异表达基因表达水平的热图。e) 癌症相关成纤维细胞(CAFs)的重新聚集和通过t-SNE图可视化每个亚型的轮廓。f) 基因表达高度可变的CAFs的拟时序轨迹分析。伪时间曲线上的每个点代表一个单元格,并根据其集群标签着色。g) 内皮细胞(ECs)重新聚集,并通过t-SNE图显示各亚型的轮廓。h)基因表达高度可变的内皮细胞的拟时序轨迹分析。伪时间曲线上的每个点代表一个单元格,并根据其集群标签着色。i)壁细胞(mc)的重新聚集和通过t-SNE图显示每个亚型的轮廓。
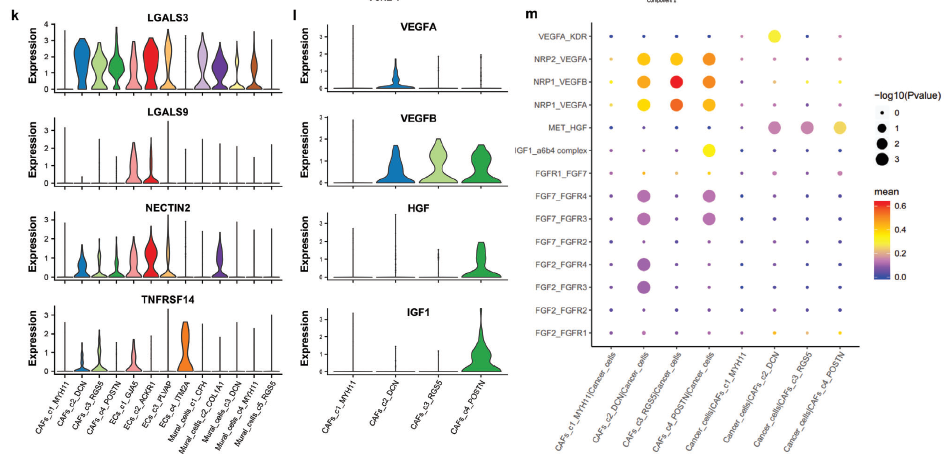
j) 基因表达高度可变的mc的拟时序轨迹分析。伪时间曲线上的每个点代表一个单元格,并根据其集群标签着色。k) 小提琴图显示各基质细胞亚型中免疫检查点基因(LGALS3, LGALS9, NECTIN2和TNFRSF14)的表达水平。l) 小提琴图显示基质细胞亚型中细胞生长因子基因(VEGFA, VEGFB, HGF和IGF1)的表达水平。m) 点图,显示CellphoneDB 2方法预测的每个CAF簇与癌细胞之间的细胞生长因子配体-受体对。
结论:
由于癌细胞的克隆进化、浸润细胞的免疫表型转移和器官特异性生态位,转移性肿瘤比原发肿瘤表现出更深刻的免疫抑制微环境。
在本研究中,我们首先提供了对肝转移和脑转移乳腺癌样本的高分辨率分析,确定了多种主要细胞类型,包括癌细胞、淋巴细胞、髓样细胞、基质细胞和器官特异性常驻细胞。分析每个细胞簇的分子特征、调节因子、动力学和功能,探讨其在转移性肿瘤进展和免疫逃逸中的作用。在肿瘤细胞中鉴定出6种具有不同细胞状态和生物学功能的共同表达程序,包括增殖维持、转移激活、免疫逃避、抵抗应激、代谢重编程和促进炎症。
此外,一些免疫抑制细胞被鉴定为重编程转移生态系统,包括FOXP3+调节性T细胞(Treg), LAMP3+耐受性DCs (tDCs), CCL18+ m2样巨噬细胞,RGS5+癌症相关成纤维细胞和LGALS1+小胶质细胞。此外,转移性癌细胞高表达CD47, CD47与巨噬细胞抑制性受体信号调节蛋白?(SIRP?)相互作用,传递“不要吃我”的信号,阻止巨噬细胞吞噬。这些细胞簇也可能成为乳腺癌肝、脑转移免疫治疗的靶点。
免疫检查点疗法已被证明对多种晚期实体肿瘤有效,其在抗肿瘤药物研究中的应用迅速发展。最近的研究表明,尽管乳腺癌曾被认为是一种免疫静止性肿瘤,但一些转移性乳腺癌亚群可能对抗pd -1/L1免疫检查点治疗反应良好然而,与其他部位转移的患者相比,肝或脑转移患者对抗pd -1/L1免疫检查点抑制剂的应答较差。
文章中的单细胞转录组数据显示,CD8+ T细胞中PD-1检查点分子低表达,LAG3和TIGIT检查点分子高表达。此外,免疫检查点配体PD-L1/2在癌细胞、免疫细胞或基质细胞中几乎不表达。LAG3与TIGIT配体、LGALS3、NECTIN2分别在上述细胞中高表达。
总之,本研究揭示了肝转移性乳腺癌和脑转移性乳腺癌的瘤内异质性和免疫抑制肿瘤生态系统,这为免疫检查点治疗耐药性的机制提供了深刻的见解,并为这些患者制定精确的免疫治疗策略提供了信息。